福建省妇幼保健院 350001
1型糖尿病是一种自身免疫性疾病,是由于胰岛β细胞破坏,导致胰岛素分泌不足而致病。随着生活水平的提高,1型糖尿病患儿的发病率在全球呈逐年递增的趋势,糖尿病的并发症有视网膜病变、肾脏病变、心脑血管病变等,其中,与糖尿病有关的骨并发症给糖尿病患者的生活带来不可忽视的影响。既往研究发现,1型糖尿病患儿的骨密度减少,骨质疏松和骨折的发生率较非糖尿病者明显提高(1-4)。
胰岛素是治疗儿童糖尿病的最有效药物,研究表明,胰岛素治疗可以促进患者骨钙素合成,增加糖尿病患者的骨密度,对维持患者骨代谢稳定有重要作用(5-9),但其机制尚不清楚,目前关于该方面的研究仍然相对较少。
骨代谢相关基因及其调控通路主要包括Wnt/β-catenin信号通路、PPAR-γ信号通路和TGF-β信号通路,这些信号通路在骨代谢过程中发挥关键作用,干扰某些靶基因的表达,可以激活或阻断其信号的转导(10-13),胰岛素通过哪一条骨代谢通路起到骨保护作用?
骨硬化蛋白(Sclerostin)属于糖蛋白类Dan家族的一员,是由SOST基因编码的、骨细胞分泌的蛋白质,是一个新的骨形态发生蛋白抑制物(14),通过与 LRP5/6结合,从而达到拮抗Wnt蛋白、抑制骨细胞成熟分化、促进其凋亡的目的(15),是时下骨质疏松领域研究的热点之一,近年其在糖尿病骨损害的发病机制中的作用备受关注(16)。动物实验提示sclerostin单克隆抗体对于骨折愈合存在促进作用,其机制与影响Wnt/β-catenin通路有关(17, 18)。研究发现,在糖尿病患儿及糖尿病大鼠血液中,Sclerostin水平升高,而在胰岛素治疗后,其水平降低(19, 20)。胰岛素可能通过Wnt/β-catenin信号通路发挥其骨保护作用。
本研究旨在探讨胰岛素的骨保护作用及其与Wnt/β-catenin信号通路的关系,为糖尿病性骨质疏松的防治提供新的思路。
1.1材料
选取30只SPF级SD雄性大鼠,体重范围在180g-220g、中效胰岛素注射液、CT扫描仪(Bruker)、ALP、OCN检测试剂盒、β-catenin Antibody、Sclerostin Antibody、BMP-2 Antibody、BCA蛋白定量试剂盒、预染蛋白marker、化学发光检测试剂、高脂高糖 (HFHS)饲料:15% 猪油、30% 蔗糖、2% 胆固醇、1% 胆酸钠、5% 蛋白粉和47%、普通饲料:玉米30%,小麦31%,豆粕20.8%,麦数10%,鱼粉6%,酵母粉1%,骨粉1%,盐0.02%,多维素0.02%,鱼肝油0.01%,油0.05%。
1.2方法
1.2.1 脂高糖饮食:30只雄性健康SD大鼠,检测血糖、体重。随机分为对照组(NC组)和造模组。造模组给予高脂高糖饲料(High sugar and high fat diets, HSFDs)喂养,对照组予以普通饲料8周。
1.2.2 建造糖尿病大鼠模型:HSFDs8周后予造模组小剂量(30mg/kg)STZ一次性腹腔注射,对照组予以等剂量的生理盐水注射。72小时后,尾静脉采血,测空腹血糖,连续3次空腹血糖≥16.0mmol/L者,确定为造模成功的糖尿病大鼠。
1.2.3 动物分组:将造模成功的糖尿病大鼠随机分成糖尿病组(DM)、胰岛素干预组(DMI)。糖尿病组和胰岛素干预组大鼠继续给予高脂高糖饲料,对照组予普通饲料喂养。
1.2.4 胰岛素治疗:糖尿病模型造模成功2周后开始给予胰岛素干预组大鼠接受中效胰岛素治疗, 8 u/d分两次颈背部皮下注射,其他两组给予同等计量的生理盐水灌胃。
1.2.5 骨密度检测:采用microCT来评价胰岛素对股骨微结构的影响。取三组大鼠左侧股骨置于CT仪器中进行扫描,应用三维重建处理和分析软件对骨密度进行检测。
1.2.6 RT-PCR检测:提取总RNA,qPCR法检测各组大鼠右股骨β-catenin、Sclerostin和BMP-2基因的表达水平。
1.2.7 Western blot检测:提取总蛋白,WB法检测各组大鼠右股骨β-catenin、Sclerostin和骨形态蛋白-2(Bone morphogenetic protein 2,BMP-2)的表达水平。
1.2.8 血清学检测:ELISA检测血清中血清碱性磷酸酶(Alkaline phosphatase,ALP)、骨钙素(Osteocalcin,OCN)。
1.3 数据处理:所有数据均以平均值±标准差(Mean±SD)的形式展示。采用单因素方差分析比较组间差异。所有统计分析在GraghPad 7.0软件上完成,P<0.05时被认为组间具有统计学差异,用不同的符号表示。
2.结果
2.1 一般状态观察:整个实验过程中,无大鼠其他疾病或死亡。NC组大鼠生长良好,体重稳步增加,饮食活动无异常。DM组、DMI组出现多饮、多食、多尿,体重相对减轻的症状。除此之外,毛发干枯,易脱落、日常活动减少,反应与造模前及NC组相比较迟钝。DMI组大鼠经胰岛素治疗后体重增加,精神状态、反应及日常活动较前有所提高。
2.2空腹血糖测定:如图1所示,DM组及DMI组大鼠空腹血糖显著高于正常组,经胰岛素给药治疗后的DMI组大鼠空腹血糖有所下降但仍高于NC组。

图1 各组空腹血糖检测
**与对照组相比p<0.01;##与糖尿病组相比p<0.01
2.3骨密度检测结果如图2所示,与NC组相比,DM组及DMI组大鼠股骨骨密度明显降低,与DM组相比,胰岛素治疗后的DMI组大鼠股骨骨密度有所提高但仍低于NC组。

图2 各组骨密度检测
**与对照组相比p<0.01;#与糖尿病组相比p<0.05
2.4 RT-PCR检测:qPCR法检测各组大鼠右股骨β-catenin、Sclerostin和BMP-2 RNA的表达水平,结果如图3所示,与NC组相比,DM组及DMI组大鼠中BMP-2、β-catenin表达明显下降,Sclerostin表达明显提高;与DM组相比,经胰岛素治疗后的DMI组大鼠中BMP-2、β-catenin表达有所升高但仍低于NC组,Sclerostin表达有所下降但仍高于NC组。
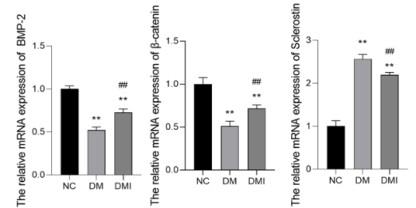
图3 各组BMP-2、β-catenin、Sclerostin RNA表达水平
**与对照组相比p<0.01;##与糖尿病组相比p<0.05
2.5 WB检测:提取总蛋白,WB法检测各组大鼠右股骨β-catenin、Sclerostin和BMP-2蛋白的表达水平,结果如图4所示,与NC组相比,DM组及DMI组大鼠中BMP-2、β-catenin表达明显下降,Sclerostin蛋白表达明显提高;与DM组相比,经胰岛素治疗后的DMI组大鼠中BMP-2、β-catenin表达有所升高但仍低于NC组,Sclerostin蛋白表达有所下降但仍高于NC组。

图4各组BMP-2、β-catenin、Sclerostin蛋白表达
**与对照组相比p<0.01;##与糖尿病组相比p<0.05
2.6血清学检测:ELISA检测血清中ALP、OCN,结果如表1所示。与NC组相比,DM组和DMI组大鼠中ALP、OCN表达明显降低;与DM组相比,DMI组大鼠中ALP、OCN表达有所升高但仍低于NC组。
表1 各组ALP、OCN的表达
分组 | NC组 (10只) | DM组 (10只) | DMI组 (10只) |
ALP(U/L) | 145.43±12.89 | 64.95±10.79* | 95.26±7.40*# |
OCN(ng/ml) | 31.34±2.34 | 17.19±2.56* | 24.67±2.48*# |
*与对照组相比p<0.05;#与糖尿病组相比p<0.05
3.讨论
1型糖尿病(type 1 diabetes mellitus,T1DM)属于自身免疫性疾病,是遗传易感的个体在饮食、化学物质及微生物感染等环境因素作用下诱发的以胰腺炎为病理特征的胰岛β细胞自身免疫反应,胰岛 β细胞损伤导致合成和分泌胰岛素的功能丧失,引起的糖代谢紊乱。T1DM约占儿童期各型糖尿病总数的90%,是危害儿童健康的重大儿科内分泌疾病,研究发现(21),我国 0-4岁、5-9岁和10-14岁儿童T1DM发病率分别每年为 0.69/10万人、2.08/10万人和2.18/10万人,其中0-4 岁年龄组发病率增速最快,提示发病呈现低龄化趋势。
1型糖尿病并发症是影响患儿长期生存的主要因素,大家关注较多的是糖尿病肾病、糖尿病视网膜病变及大血管并发症,对于糖尿病性骨质疏松(diabetic oteoporosis,DOP)的关注相对较少。DOP发病机制尚不明确,可能主要由于机体高血糖状态、氧化应激反应和晚期糖基化产物积累等众多因素共同导致,同时受体内骨代谢、糖脂代谢等相关因素影响(22)。DOP主要表现为骨量低、骨骼脆性增加、骨质量下降和骨折风险增加。既往研究发现(1, 23),T1DM患者的骨密度减少,发生骨折的风险升高,本研究显示,相比对照组,糖尿病小鼠的股骨骨密度减少,ALP、OCN表达降低,支持既往研究结论。由于DOP早期症状不明显,同时对其的治疗手段又十分有限,造成患者知晓率低、致残率高的现状,给社会和患者家庭带来极大的经济负担。
目前1型糖尿病的主要治疗方法是胰岛素,本研究发现,胰岛素治疗后,糖尿病大鼠的骨密度提高。既往研究也发现(24-29),无论是临床、体内实验,还是体外实验,均发现,胰岛素具有促进T1DM骨形成的作用,对维持骨代谢平衡有重要的意义,但其具体机制尚不明确,有学者认为(24),外源胰岛素与糖尿病骨质疏松患者成骨细胞膜表面的胰岛素受体结合,使I型胶原的合成增加,进而促进骨的形成。
本研究发现,相比对照组,糖尿病组大鼠骨硬化蛋白(Sclerostin)mRNA及蛋白的表达明显增加,β-catenin表达下降,而经胰岛素治疗后的糖尿病大鼠,骨硬化蛋白(Sclerostin)mRNA及蛋白的表达有所下降,β-catenin表达增加。骨硬化蛋白是一种由骨细胞分泌的骨形成抑制因子,其可抑制Wnt信号通路,如,调控BMP-2、OPG、核转录因子-κB受体活化因子配体(RANKL),促进骨质疏松的发生、发展,因而可成为治疗骨质疏松的新靶点(15)。Wnt信号通路在细胞内的转导有4种途径 :经典通路 、平面细胞极性通路、Wnt/Ca2+通路以及调节纺锤体定向和不对称细胞分裂的通路,其中,经典通路对骨形成起主要作用。经典通路即Wnt/β-catenin信号通路能够促进骨髓间充质干细胞向成骨细胞分化,增加骨形成,而Wnt/β-catenin信号通路主要由骨硬化蛋白和DKK-1两种拮抗剂(30)。研究发现(31),糖尿病患者中的骨硬化蛋白升高,这与本研究相符,再次证实了糖尿病患儿骨量丢失时骨硬化蛋白水平增加。
综上所述,本研究发现糖尿病大鼠的骨损害在胰岛素治疗后得到一定程度的改善,其中,骨硬化蛋白起着重要的作用。骨硬化蛋白可抑制Wnt /β-catenin信号通路,从而导致骨质疏松的发生,是骨质疏松治疗领域中的研究热点,本研究认为,胰岛素通过抑制骨硬化蛋白的表达,激活Wnt/β-catenin信号通路而起到骨保护作用。
参考文献
1.Loxton P, Narayan K, Munns CF, Craig ME. Bone Mineral Density and Type 1 Diabetes in Children and Adolescents: A Meta-analysis. Diabetes Care. 2021;44(8):1898-905.
2.Zhu Q, Xu J, Zhou M, Lian X, Xu J, Shi J. Association between type 1 diabetes mellitus and reduced bone mineral density in children: a meta-analysis. Osteoporosis international : a journal established as result of cooperation between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA. 2021;32(6):1143-52.
3.孟初晨,赵丹,成金罗,叶新华. 青中年1型糖尿病及合并微血管并发症者骨密度变化. 中国骨质疏松杂志. 2021;5(27):689-93.
4.Madsen JOB, Herskin CW, Zerahn B, Jørgensen NR, Olsen BS, Pociot F, et al. Decreased markers of bone turnover in children and adolescents with type 1 diabetes. Pediatric Diabetes. 2020;21(3):505-14.
5.Bortolin RH, Freire Neto FP, Arcaro CA, Bezerra JF, da Silva FS, Ururahy MA, et al. Anabolic Effect of Insulin Therapy on the Bone: Osteoprotegerin and Osteocalcin Up-Regulation in Streptozotocin-Induced Diabetic Rats. Basic & clinical pharmacology & toxicology. 2017;120(3):227-34.
6.Jeffry S. Nyman EK, R. Clay Bunn, Sasidhar Preserving and restoring bone with continuous insulin infusion therapy in a mouse model of type 1 diabetes. Bone Reports. 2017;7:1-8.
7.Maria Felicia Faienza GB, Lorenzo Sanesi , Graziana Colaianni,Monica Celi. High irisin levels are associated with better glycemic control and bone health in children with Type 1 diabetes. Diabetes Research and Clinical Practice. 2018;141(10):10-7.
8.Shi P, Hou A, Li C, Wu X, Jia S, Cen H, et al. Continuous subcutaneous insulin infusion ameliorates bone structures and mechanical properties in type 2 diabetic rats by regulating bone remodeling. Bone. 2021;153:116-31.
9.Jackuliak J, KuŽMa M, Payer J. Effect of Antidiabetic Treatment on Bone. Physiological Research. 2019;68(2):107-20.
10.赵雪丹 向, 杨晶晶. AMPK通路在骨代谢中调节作用的研究进展. 中国骨质疏松杂志. 2021;27(7):1088-92.
11.彭小婷 宋, 赵文豪,方欢欢,王鑫,高雪,刘雨欣,李微. 骨代谢信号通路的研究进展. 科技风. 2021(17):80-1.
12.Guo J, Ren R, Sun K, He J, Shao J. PERK signaling pathway in bone metabolism: Friend or foe? Cell proliferation. 2021;54(4):1-12.
13.Sun Q, Liu S, Feng J, Kang Y, Zhou Y, Guo S. Current Status of MicroRNAs that Target the Wnt Signaling Pathway in Regulation of Osteogenesis and Bone Metabolism: A Review. Medical science monitor : international medical journal of experimental and clinical research. 2021;27:101-8.
14.Del Real A, Perez-Campo FM, Perez-Nuñez MI, Sañudo C, Santurtun A, Garcia-Ibarbia C, et al. Methylation of the Sclerostin (SOST) Gene in Serum Free DNA: A New Bone Biomarker? Genetic testing and molecular biomarkers. 2021;25(1):42-7.
15.金泽旭,唐芳,马武开. Wnt 信号通路抑制因子骨硬化蛋白在骨质疏松症中的
作用探讨. 风湿病与关节炎. 2020;9(4):45-8.
16.Wedrychowicz A, Sztefko K, Starzyk JB. Sclerostin and its significance for children and adolescents with type 1 diabetes mellitus (T1D). Bone. 2018;120:387-92.
17.Dreyer T, Shah M, Doyle C, Greenslade K, Penney M, Creeke P, et al. Recombinant sclerostin inhibits bone formation in vitro and in a mouse model of sclerosteosis. Journal of orthopaedic translation. 2021;29:134-42.
18.Costa S, Fairfield H, Farrell M, Murphy CS, Soucy A, Vary C, et al. Sclerostin antibody increases trabecular bone and bone mechanical properties by increasing osteoblast activity damaged by whole-body irradiation in mice. Bone. 2021;147:115-9.
19.Faienza MF, Ventura A, Delvecchio M, Fusillo A, Piacente L, Aceto G, et al. High Sclerostin and Dickkopf-1 (DKK-1) Serum Levels in Children and Adolescents With Type 1 Diabetes Mellitus. The Journal of clinical endocrinology and metabolism. 2017;102(4):1174-81.
20.Baroi S, Czernik PJ, Chougule A, Griffin PR, Lecka-Czernik B. PPARG in osteocytes controls sclerostin expression, bone mass, marrow adiposity and mediates TZD-induced bone loss. Bone. 2021;147:115-9.
21.Gong C, Meng X, Jiang Y, Wang X, Cui H, Chen X. Trends in childhood type 1 diabetes mellitus incidence in Beijing from 1995 to 2010: a retrospective multicenter study based on hospitalization data. Diabetes technology & therapeutics. 2015;17(3):159-65.
22.黄燕霞,梅思,方学红,刘义. 糖尿病性骨质疏松的研究进展. 临床与病理杂志. 2020;40(1):182-7.
23.Wang H, Ba Y, Xing Q, Du JL. Diabetes mellitus and the risk of fractures at specific sites: a meta-analysis. BMJ open. 2019;9(1):e024067.
24.韩松梅,陈莉丽. 胰岛素与骨代谢的关系. 海南医学. 2017;28(10):1657-60.
25.Sherk VD, Schauer I, Shah VN. Update on the Acute Effects of Glucose, Insulin, and Incretins on Bone Turnover In Vivo. Current osteoporosis reports. 2020;18(4):371-7.
26.Liu D, Bai JJ, Yao JJ, Wang YB, Chen T, Xing Q, et al. Association of Insulin Glargine Treatment with Bone Mineral Density in Patients with Type 2 Diabetes Mellitus. Diabetes, metabolic syndrome and obesity : targets and therapy. 2021;14:1909-17.
27.Johansen NJ, Dejgaard TF, Lund A, Schluntz C, Hartmann B, Holst JJ, et al. Effects of short-acting exenatide added three times daily to insulin therapy on bone metabolism in type 1 diabetes. Diabetes, obesity & metabolism. 2022;24(2):221-7.
28.Limirio P, Soares PBF, Venancio JF, Rabelo GD, Soares CJ, Dechichi P. Type I Diabetes Mellitus and Insulin Therapy on Bone Microarchitecture, Composition and Mechanical Properties. Current diabetes reviews. 2021.
29.Suzuki M, Urai S, Fukuoka H, Hirota Y, Yamamoto M, Okada Y, et al. Relation between the insulin lowering rate and changes in bone mineral density: Analysis among subtypes of type 1 diabetes mellitus. Journal of diabetes investigation. 2022.
30.黄河清,刘志涛,刘振东. Wnt_β-Catenin信号通路与糖尿病性骨质疏松症的研究进展. 医学临床研究. 2020;37(4):485-8.
31.王健民,高启红,邱守芳,张立英. 骨硬化蛋白和+dkk1与2型糖尿病患者骨密度相关性研究. 中国骨质疏松杂志. 2019;25(7):924-8.