1中南大学材料科学与工程学院,湖南 长沙 410083; 2. 中铝洛阳铜业检测技术有限公司,河南 洛阳 471003
摘要:探究0Cr13Mo5CuTi铸钢在盐性环境下的腐蚀机制,为评估铸钢材料工程使用寿命提供依据,并为新一代耐腐蚀罗茨鼓风机的开发提供关键材料参数。将0Cr13Mo5CuTi铸钢放入含有不同浓度NH4Cl+3.5%NaCl溶液中进行腐蚀,利用电化学腐蚀和SEM观察铸钢腐蚀程度和腐蚀形貌,利用XPS观察腐蚀后的腐蚀产物,讨论0Cr13Mo5CuTi铸钢在盐性环境中的腐蚀机制,并探讨其Mo的耐腐蚀机制。得到随着NH4Cl浓度的增加,铸钢的腐蚀速率加快,同时腐蚀速率随时间增加而降低;钼元素能够加强铸钢耐腐蚀性能。
关键词:铸钢;微观结构;耐腐蚀;腐蚀产物;腐蚀形貌
铸钢因良好的机械性能、抗腐蚀等性能而应用于制作鼓风机外壳【1-3】。有研究分析了微观结构和服役环境对铸钢腐蚀性能的影响;从腐蚀热力学与动力学两方面阐述了铸钢的腐蚀机理【4】。探究0Cr13Mo5CuTi铸钢在铵盐条件下的腐蚀行为,可以了解铸钢在铵盐环境下的腐蚀机理,为进一步改善合金性能提供参考,拓宽合金的应用方向,为研制新材料提供理论支撑。
本研究使用的原料有,钼铁、铬铁、纯钛、纯铜以及纯铁。铸钢材料由KGPS-100KW中频控制电源及GW(0.005T)中频无芯感应电炉进行熔炼。在熔炼过程中,使用氩气作为保护气氛。熔炼加料顺序为钼铁、铬铁、纯铜、纯铁随炉加入,除渣剂扒渣,再加除渣剂覆盖钢液。脱氧除渣后浇筑。0Cr13Mo5CuTi铸钢化学成分如表1所示。
表1 0Cr13Mo5CuTi铸钢化学成分
元素 | C | Mo | Cr | Ti | Cu | N | Fe |
wt% | 0.015 | 5 | 13 | 0.1 | 0.5 | 0.01 | 81.2 |
将铸件用线切割分割成8×8×5mm,周期静态浸泡腐蚀实验方法参考GB/T 39534-2020《液体中不锈钢和镍基合金均匀腐蚀速率测定方法》进行,溶液采用3.5%NaCl,,3.5%NaCl+0.001mol/L NH4Cl,3.5%NaCl+0.01mol/L NH4Cl,3.5%NaCl+0.1mol/L NH4Cl。
样品采用IM6ex电化学工作站进行电化学测量。实验使用三电极测量系统测试样品的电化学极化曲线和交流阻抗谱(EIS)。工作电极设置为铸钢,辅助电极为铂电极,参比电极为饱和甘汞电极(SCE)。
X射线光电子能谱分析在K-alpha型X射线光电子能谱仪上进行。腐蚀样品在腐蚀液中浸泡后的样品经干燥后可以直接在扫描电镜下观察测试样品的表面。扫描电子显微观察Quanta-200型场发射电子显微镜上进行,获得样品表面SEM图像扫描。
图1显示了不同浓度NH4Cl的3.5%NaCl铸钢的极化曲线。阳极和阴极分支是独立得到的,以避免阴极产生的OH-离子的影响。可以发现,当加入的NH4Cl的浓度增加时,腐蚀电位呈现下降的趋势。阴极曲线在添加0.001mol/L NH4Cl时没有显着变化,而当NH4Cl浓度为0.01mol/L或更高时,阴极曲线明显向右移动,归因于双层效应和高浓度离子对的形成。随着NH4Cl含量增加至0.1mol/L,阴极动力学偏离Tafel行为,并且观察到约-1.44 VSCE的小曲率。总的来说,较高浓度的NH4Cl明显增加了腐蚀电流密度。这是一种典型的阴极控制系统,阴极动力学加速导致腐蚀速率增加。
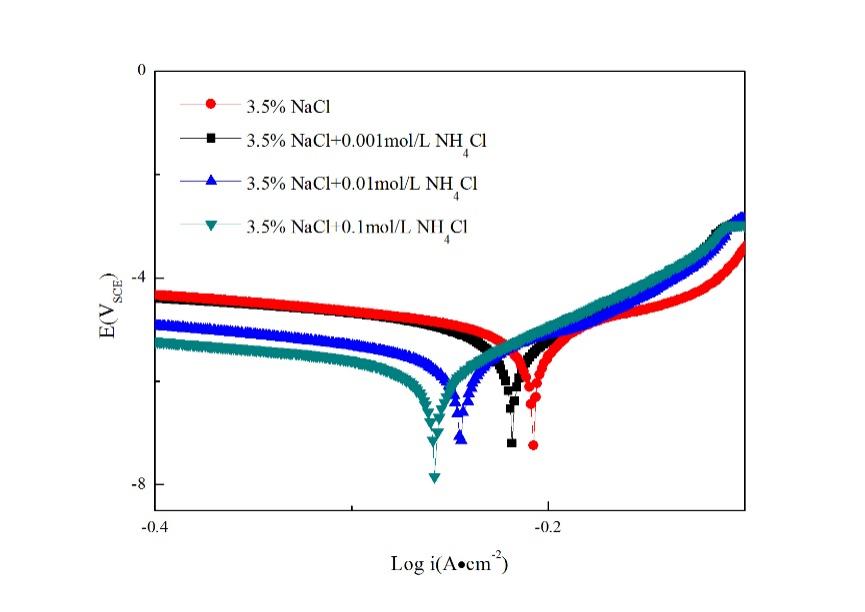
图1 在不同浓度的NH4Cl的3.5%NaCl中铸态钢的极化曲线
表2是在极化测试中拟合合金的各种参数的结果与计算出来的腐蚀速率。从表中可以看出,未加入NH4Cl时,极化电位较小,随着NH4Cl的浓度增加,每种合金的腐蚀电位逐渐减小,这表明其腐蚀趋势增大;自腐蚀电流密度与腐蚀电位有着相同的规律,当加入0.001mol/L的NH4Cl时,腐蚀电流密度迅速增加,而后随着NH4Cl的浓度增加,合金的自腐蚀电流密度也逐渐增加,这表明合金的腐蚀速率迅速加快;而合金的极化电阻则随着NH4Cl浓度的增加逐渐变小,这表明合金表面的抗腐蚀性能降低。
图2显示了,铸钢在溶液为3.5%NaCl、3.5%NaCl+0.001mol/L NH4Cl、3.5%NaCl+0.01mol/L NH4Cl以及3.5%NaCl+0.001mol/L NH4Cl中的Nyquist图。可以观察到,曲线在高频率区为半圆形状,该半圆半径的大小反映了合金表面氧化膜的阻抗值大小,半圆的半径越大,则表明其阻抗值越大,各铸钢曲线的半圆直径随着溶液中NH4Cl浓度的的增大而减小,这代表铸钢表面氧化膜产生的阻抗均随NH4Cl浓度的增大而减小,即随着NH4Cl浓度的增大,铸钢的腐蚀变得严重。
表2 拟合在不同腐蚀性介质中铸态钢所得的电化学参数
溶液 | | (A×cm-2) | (mV/Dec) | | (×103Ω·cm2) | 腐蚀速率(mm×year-1) |
3.5%NaCl | -0.206 | 8.7×10-6 | 0.93 | -0.90 | 22.86 | 1.02×10-4 |
3.5%NaCl +0.001mol/L NH4Cl | -0.224 | 1.3×10-4 | 1.36 | -1.00 | 1.84 | 1.52×10-3 |
3.5%NaCl + 0.01 mol/L NH4Cl | -0.248 | 3.8×10-4 | 1.37 | -0.97 | 0.62 | 4.44×10-3 |
3.5%NaCl + 0.1 mol/L NH4Cl | -0.267 | 7.2×10-4 | 1.49 | -1.09 | 0.38 | 8.42×10-3 |

图2 铸钢在含不同浓度NH4Cl的NaCl溶液中的Nyquist图
表3给出了铸钢分别在4种溶液中浸泡不同时间后的电化学参数。结果表明,铸钢在4种浸泡过程中等效电路具有相同变化规律,随着铸钢在溶液中浸泡时间的延长,铸钢的膜电阻 均增大,这表明种铸钢中的腐蚀产物膜均随浸泡时间的增长而变厚;表中常相位角元件CPE的系数
均增大,这表明种铸钢中的腐蚀产物膜均随浸泡时间的增长而变厚;表中常相位角元件CPE的系数 随浸泡时间的延长而下降,而另一系数
随浸泡时间的延长而下降,而另一系数 则随时间延长而升高,这表明铸钢的腐蚀产物膜厚度增加。而铸钢的固相扩散阻抗
则随时间延长而升高,这表明铸钢的腐蚀产物膜厚度增加。而铸钢的固相扩散阻抗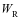 和电荷传递电阻
和电荷传递电阻 均随浸泡时间的延长而增大则表明腐蚀速率则随时间的延长而降低。
均随浸泡时间的延长而增大则表明腐蚀速率则随时间的延长而降低。
表3 铸钢在不同腐蚀性介质中浸泡不同时间后的电化学参数拟合
溶液 | 时间 | | (106 | n1 | | | Cfilm×10-4 (μF/cm2) | Rfilm
| |
3.5%NaCl | 1h | 8.62 | 497 | 0.49 | 21 | 763 | 1.86 | 207 | |
1day | 8.14 | 355 | 0.57 | 27 | 2371 | 1.53 | 372 | | |
5day | 8.91 | 349 | 0.79 | 89 | 2748 | 1.47 | 395 | | |
3.5%NaCl+ 0.001mol/L NH4Cl | 1h | 7.69 | 398 | 0.24 | 19 | 675 | 2.15 | 182 | |
1day | 7.74 | 312 | 0.33 | 25 | 1784 | 1.92 | 298 | | |
5day | 7.83 | 294 | 0.51 | 63 | 1959 | 1.85 | 317 | | |
3.5%NaCl+ 0.01mol/L NH4Cl | 1h | 7.40 | 385 | 0.29 | 10 | 563 | 2.53 | 164 | |
1day | 6.74 | 337 | 0.38 | 23 | 1478 | 2.44 | 268 | | |
5day | 6.64 | 320 | 0.52 | 52 | 1739 | 1.81 | 295 | | |
3.5%NaCl+ 0.01mol/L NH4Cl | 1h | 9.12 | 413 | 0.36 | 13 | 514 | 2.67 | 143 | |
1day | 8.07 | 351 | 0.47 | 19 | 1573 | 2.54 | 229 | | |
5day | 8.58 | 333 | 0.62 | 47 | 1691 | 1.96 | 254 | | |
图3为铸钢在3.5%NaCl+0.1mol/L NH4Cl溶液中分别浸泡1小时和120小时后表面腐蚀产物的,Mo3d谱图。(a),(b)中Mo3d光谱由三个峰组成,根据结合能可分为金属Mo,MoO3和MoO2,且可以观察到浸泡1小时和120小时后的Mo3d峰宽及峰面积基本相同,这表明表面的钼产物在浸泡早期就已经形成,并其含量不随着时间的延长而产生较大的变化。

(a)
(b)

图3铸钢在3.5%NaCl+0.1mol/L NH4Cl溶液中分别1小时和120小时后表面的Mo3d的XPS图谱和分峰结果: (a)1小时;(b) 120小时
图4为铸钢在3.5%NaCl+0.1mol/L NH4Cl溶液中浸泡不同时间后O1s峰的谱图和分峰结果。由于化合物Fe2O3、Cr2O3以及Mo氧化物(MoO2和MoO3)中所需的氧离子所对应的结合能非常接近,因此为了避免分成过多峰而造成的误差,将这些化合物所对应的的峰作为同一个峰处理,记做Fe2O3(Cr2O3、MoOx),同理把Fe(OH)3和Cr(OH)3作为同一个峰处理,记为Fe(OH)3(Cr(OH)3)。由图可见铸钢在3.5%NaCl+0.1mol/L NH4Cl溶液中浸泡1小时后表面产物主要有Fe2O3、Cr2O3和MoOx以及Fe(OH)3和Cr(OH)3,其中的氧化物峰Fe2O3、Cr2O3和MoOx的面积明显大于Fe(OH)3和Cr(OH)3峰的峰面积。
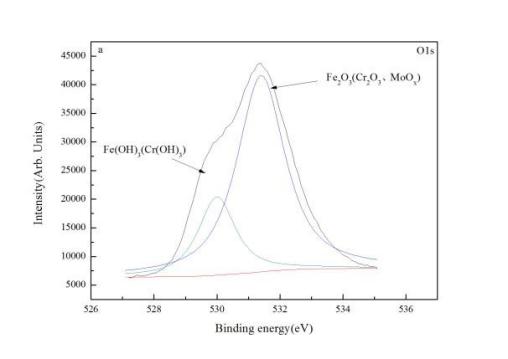

(a)
(b)
图4 铸钢在3.5%NaCl+0.1mol/L NH4Cl溶液中分别1小时和120小时后表面的O1s的XPS图谱和分峰结果:(a)1小时;(b) 120小时
不同时间样品SEM图像如图5所示。可以观察到浸泡在纯NaCl中1小时后(图5 a1),表面形成一些白色凹坑。浸泡24小时后,腐蚀没有传播(图5 a2)。进一步将浸泡时间增加到72小时,在表面上产生一些微裂纹(图5 a3)。当浸泡时间延长至120小时时,微裂纹演变成大孔(图5 a4)。这可归因于这些区域含碳酸盐腐蚀产物的导电性差。加入0.001mol/L NH4Cl,微观形态与纯NaCl形态差异很大,表面产生许多微裂纹,且腐蚀随时间变得严重(图5 b3-b4)。当0.01mol/L的NH4Cl加入到NaCl溶液中,试样表面没有腐蚀产物可以在表面上观察到(图5 c1-c4)。在含有0.1mol/L的NH4Cl的NaCl溶液,浸泡1小时微观形态是与在纯NaCl的类似(图5 a1),浸渍24小时(图5 d2)后,钢的表面产生点孔,并成为与浸泡时间的上升的情况下(图5 d2-d3)当浸泡时间延长到120小时,一些黑色腐蚀产物局部分布(图5 d4)。综合图片可以看出,随着NH4Cl浓度的增加,铸钢表面的腐蚀产物增多,但表面都较均匀;随着浸泡时间的增加,各样品的腐蚀程度都有不同程度的加深。
溶液 浸泡时间 | 1小时 | 24小时 | 72小时 | 120小时 |
3.5%NaCl | a1 | a2 | a3 | a4 |
3.5%NaCl+0.001 mol/L NH4Cl | b1 | b2 | b3 | b4 |
3.5%NaCl+0.01 mol/L NH4Cl | c1 | c2 | c3 | c4 |
3.5%NaCl+0.1 mol/L NH4Cl | d1 | d2 | d3 | d4 |
图5 铸钢在4种溶液中浸泡不同时间的SEM图
XPS分析证明腐蚀产物由Cr(OH)3、Fe2O3、Cr2O3、Fe(OH)3、Cr(OH)3和一些氯化物组成。在铸钢的浸泡试验中,Fe(OH)2和Cr2O3最初沉淀,Fe(OH)2易于破坏,并作为其他腐蚀产物形成的前体。
开始浸泡时主要的阳极反应是:
 (1)
(1)
 (2)
(2)
接着生成FeOOH与FeO:
 .(3)
.(3)
 (4)
(4)
相应的阴极反应是:
 (5)
(5)
Cr与FeOOH发生反应生成CrOOH:
 (6)
(6)
同时FeOOH与CrOOH分别能水解成Fe2O3与Cr2O3:
 .(7)
.(7)
 (8)
(8)
Mo与FeO可以发生反应:
 . (9)
. (9)
随着浸泡时间的延长,H2的释放减少,所需的阴极反应转化为:
 .(10)
.(10)
可见,钝化膜最表层有Fe2O3、Fe(OH)3、FeOOH、Cr2O3、CrOOH、Cr(OH)3及以MoOx形式存在的Mo,钝化膜主要成分为Cr2O3、Fe2O3与Mo氧化物。
图3显示了在样品上形成的钝化膜的Mo3d XPS光谱。Mo3d光谱由三个峰组成,分别为金属Mo,MoO3和MoO2,其中MoO3能与OH-形成钼酸盐:
 (11)
(11)
钼酸盐是一种良好的无机缓蚀剂,在铸钢中可以与铁离子形成难溶或不溶盐沉淀,从而减速腐蚀:
 (12)
(12)
由此可见钼的氧化物提高了钝化膜的耐腐蚀性能。
对比图4a与图4b,氧化物的峰宽及峰面积随时间皆略微增大,说明随着浸泡时间的进行,Cr2O3的含量增多,而Cr(OH)3的含量下降,这是由于氧化钼的存在增强了Cr向Cr2O3转变的趋势。与Cr(OH)3相比,Cr2O3具有较低的点缺陷浓度(即阳离子空位)【5】。因此,钝化膜中更多的Cr2O3可以显着提高铸钢在铵溶液中的耐腐蚀性。
0Cr13Mo5CuTi铸钢表面的钝化膜均随着浸泡时间的延长而增厚增密;铸钢的腐蚀速率随着浸泡时间的增加而降低。因此,0Cr13Mo5CuTi铸钢具有良好的耐NH4Cl腐蚀的能力。
钼元素在NH4Cl混合腐蚀溶液中形成的MoO3能与OH-反应生成钼酸盐,后者是一种良好的无机缓蚀剂,能与Fe2+形成沉淀从而减缓腐蚀;同时钼氧化物能促进铬元素向Cr2O3转变,而Cr2O3比Cr(OH)3的点缺陷浓度低,从而使得铸钢具有更好的耐蚀性能。
参考文献
[1]陈利娟,李骞,杨永斌,钟强,何威,王明.金氰化溶解过程的电化学行为及形貌特征[J].矿冶工程,2021,41(04):88-92.
[2] 张亚,王天乐.中性洗煤环境钢结构高效缓蚀剂的缓蚀性能研究[J].矿冶工程,2019,39(03):136-140.
[3]刘冠华,刘志义,柏松,曹靖,王建.不同峰时效处理后Al-Cu-Mg-Ag合金的显微组织和晶间腐蚀性能[J].矿冶工程,2020,40(03):116-119+132.
[4] 易丹青, 陈丽勇, 刘会群,等. 硬质合金电化学腐蚀行为的研究进展[J]. 硬质合金, 2012, 29(4): 238-253.
[5]邓莎,顾帼华,贺国帅.酸性体系下不同成因黄铁矿的浸出行为与电化学性质差异[J].矿冶工程,2021,41(01):85-89.
第一作者:雷雨(1969-)女 四川南充人 学士 中铝洛铜从事技术研发和质量管理工作
通讯作者:曾儒正(1997-)男 湖南衡阳人 硕士研究生 主要研究课题为NiCrFe合金制造