北京市仁和医院 神经外科 ,北京 102600
摘要 目的:探讨不同手术时机行微创血肿穿刺术对治疗中等量基底节血肿的并发症及疗效的影响。方法:104例自发性中等量基底节血肿患者,根据手术时机的不同,分为超早期组(﹤6h)32例;早期组(6h-48h)44例;延期组(﹥48h)28例。比较3组患者术后再出血、颅内感染及ADL近远期分级等的差异。结果:(1)3组病例患者年龄、GCS评分的差异无统计学意义(P>0.05),血肿体积有统计学差异(P﹤0.05),延期组血肿体积最小。(2)3组病例患者血肿腔注射尿激酶后血肿清除率差异无统计学意义(P>0.05)。(3)3组病例患者术后保留引流管时间和血肿腔注射尿激酶次数差异有统计学意义(P﹤0.05),延期组患者引流时间最短,血肿腔注入尿激酶次数最少。(4)3组病例患者再出血差异有统计学意义(P﹤0.05),延期组最低。颅内感染差异有统计学意义(P﹤0.05),延期组最低。肺部感染差异无统计学意义(P>0.05)。(5)术后14天3组病例患者ADL分级差异有统计学意义(P﹤0.05),早期组、延期组显著优于超早期组。术后3个月3组病例患者ADL分级差异无统计学意义(P>0.05)。结论:治疗中等量基底节血肿,发病6小时后行微创血肿穿刺术可获得较好的近远期疗效,对于意识清楚、血肿体积较小的患者,推迟手术至发病48小时后可降低再出血率、颅内感染率,获得最优的手术效果。
高血压性基底节脑出血是由血压急剧升高导致脑内血管破裂的自发性脑血管病。其症状取决于血肿的部位、大小及扩大速度[1]。基底节区是高血压脑出血好发部位。对于中等量基底节血肿(25-50ml)患者来说,手术治疗已经证实可以降低其病死率及并发症的发生率。微创血肿穿刺术具有操作简单、创伤性小、安全可靠等优点,但存在术后发生再出血、颅内感染等风险,手术时机也还存在争议。本研究回顾性分析104例自发性中等量基底节脑出血患者资料,现将治疗效果报告如下。
资料与方法
1.1 一般资料 2014年1月-2020年12月北京市仁和医院神经外科收治的自发性中等量基底节区脑出血104例,其中男性59例,女性45例;年龄为28-83岁,平均62.4±14.2岁;入院格拉斯哥昏迷评分(GCS)12-15分,平均13.4±1.2分;所有患者术前均行头颅CT检查,血肿体积25-48ml,平均36.8±5.5ml。
纳入标准:(1)诊断符合《高血压性脑出血中国多学科诊疗指南-2020版》的诊断标准,头颅CT证实。(2)出血部位位于基底节区,根据多田公式计算血肿量为25-50ml。(3)入院至术前GCS评分≧12分。(4)患者家属同意手术并签署手术同意书。排除标准:(1)血肿破入三、四脑室,或脑积水。(2)外伤、服用抗凝药物或血管畸形脑出血者。(3)合并全身其他器官严重病变。
按发病后手术时间分为超早期组(﹤6h)32例;早期组(6h-48h)44例;延期组(﹥48h)28例。
1.2 手术方法及围手术期处理 患者平卧位,根据头颅CT标记血肿最大层面的体表投影,与中线同侧旁开2.5-3cm交点为穿刺点。局部浸润麻醉后,锥颅,刺破硬膜,方向沿血肿最大层面且平行于矢状面,置入一个头端多侧孔的外径4.9mm,内径2.6mm带芯硅胶引流管于血肿中心稍远位置。基底节血肿进针深度8-11cm,平均9.0cm。拔出针芯,5ml注射器回抽可见暗红色陈旧血,证明引流管已位于血肿腔,如阻力小可缓慢抽吸血肿,抽吸血肿总量不要超过血肿总量的1/4,抽吸过程遇阻力则停止。固定引流管,连接引流瓶,低位引流。术后未清除的血肿通过注入尿激酶,促进其溶解排出。3组术后均常规给予降颅压、降血压、抗感染、肠内营养、支持及对症治疗。定期复查头颅CT以了解拔除引流管后血肿清除率[血肿清除率(%)=(术前血肿量-残余血肿量)/术前血肿量×100%]情况、有无再出血等情况。
1.3 疗效评价 分别于术后第14天、3个月采用改良日常生活活动能力(activities of daily living,ADL)分级评估手术疗效,分为Ⅰ-Ⅴ级,包括Ⅰ级(日常生活完全恢复)、Ⅱ级(生活基本自理)、Ⅲ级(生活部分自理)、Ⅳ级(卧床但有意识)、Ⅴ级(植物状态生存)。记录住院期间主要并发症再出血、术后颅内感染、肺部感染的例数。记录引流管保留时间(天数)及引流期间血肿腔内注射尿激酶的次数。根据多田公式计算拔出引流管后残余的血肿量。
1.4 统计方法 采用SPSS 24.0软件对数据进行分析处理。符合正态分布的计量资料以x±s表示,组间比较采用方差分析。计数资料采用例数或百分比表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1手术结果:104例患者均行经额微创血肿穿刺术治疗,其中5例患者术中躁动行静脉镇静麻醉,所有患者术中均未行气管插管术。血肿清除率为33.3%-87.2%,平均72.7%±10.1%。35例(33.7%)患者术后出现并发症,10例(9.6%)患者出现再出血,其中2例因血肿量较大中转行开颅手术治疗,1例行经颞侧血肿穿刺引流术,双管引流;13例(12.5%)患者出现颅内感染,均经腰大池引流或腰穿治疗后好转;28例(26.9%)患者出现肺部感染,其中4例(3.8%)患者行气管切开术,其余患者经静脉抗炎治疗后好转;3例(2.9%)患者于14天后死亡,2例因再出血,1例因肺部感染。
2.2临床资料分析结果(表1):(1)3组病例患者年龄、GCS评分的差异无统计学意义(P>0.05),血肿体积有统计学差异(P﹤0.05),其中延期组血肿体积最小,与超早期组和早期组存在显著性差异。(2)3组病例患者血肿腔注射尿激酶后血肿清除率差异无统计学意义(P>0.05)。(3)3组病例患者术后保留引流管时间和血肿腔注射尿激酶次数差异有统计学意义(P﹤0.05),其中延期手术组患者引流时间最短,血肿腔注入尿激酶次数最少。(4)3组病例患者再出血率有统计学意义(P﹤0.05),延期组显著低于超早期组,与早期组无显著差异,超早期组与早期组无显著差异。颅内感染率差异有统计学意义(P﹤0.05),延期组显著低于超早期组,与早期组无显著差异,超早期组与早期组无显著差异。肺部感染率差异无统计学意义(P>0.05)。
表1 不同手术时机治疗的高血压脑出血患者临床资料和并发症比较结果
项目 | 超早期组 | 早期组 | 延期组 | 检验值 | P值 |
(n=32) | (n=44) | (n=28) | |||
年龄(x±s,岁) | 61.6±13.8 | 62.8±13.9 | 62.5±15.5 | 0.076 c | 0.927 |
入院GCS评分(x±s,分) | 13.3±1.3 | 13.5±1.3 | 13.4±1.0 | 0.278 c | 0.758 |
血肿体积(x±s,ml) | 37.3±4.6 | 37.9±5.4 | 34.4±5.9 | 4.025 c | 0.021 |
血肿清除率(x±s,%) | 72.6±10.7 | 73.0±10.6 | 72.1±9.1 | 0.063 c | 0.939 |
引流时间(x±s,天) | 6.3±1.1 | 6.2±1.1 | 3.1±1.4 | 73.175 c | ﹤0.001 |
血肿腔注药次数(x±s,次) | 15.7±2.7 | 15.5±2.9 | 3.2±3.5 | 173.559 c | ﹤0.001 |
并发症(例) | | | | | |
再出血 | 6(18.8%)a | 4(9.1%)a,b | 0(0%)b | 5.987d | 0.036 |
颅内感染 | 6(18.8%)a | 7(15.9)a,b | 0(0%)b | 6.541d | 0.036 |
肺部感染 | 9(28.1%)a | 13(29.5%)a | 6(21.4%)a | 0.607d | 0.785 |
注:GCS为格拉斯哥昏迷评分;c为F值,d为χ2值
2.3不同手术时机患者手术疗效(表2):患者ADL分级比较结果显示,术后14天3组病例患者ADL分级差异有统计学意义(P﹤0.05),早期组、延期组显著优于超早期组,早期组与延期组无显著差异。术后3个月3组病例患者ADL分级差异无统计学意义(P>0.05)。
表2 不同手术时机治疗的高血压脑出血患者术后ADL分级比较结果(例)
组别 | 总例数 | Ⅰ级 | Ⅱ级 | Ⅲ级 | Ⅳ级 | Ⅴ级 | χ2值 | P值 | |
术后14天 | | | | | | | 17.633 | 0.012 | |
超早期 | 32 | 2(6.3%)a | 3(9.4%)a | 13(40.6%)a | 12(37.5%)a | 2(6.3%)a | |||
早期 | 44 | 5(11.4%)a | 15(34.1%)b | 19(43.2%)a | 4(9.1%)b | 1(2.3%)a | |||
延期 | 28 | 3(10.7%)a | 10(35.7%)b | 13(46.4%)a | 2(7.1%)b | 0(0%)a | |||
术后3月 | | | | | | | 4.291 | 0.895 | |
超早期 | 32 | 4(12.9%)a | 16(51.6%)a | 8(25.8%)a | 2(6.5%)a | 1(3.2%)a | |||
早期 | 44 | 8(19.0%)a | 24(57.1%)a | 7(16.7%)a | 3(7.1%)a | 0(0%)a | |||
延期 | 28 | 5(17.9%)a | 16(57.1%)a | 4(14.3%)a | 3(10.7%)a | 0(0%)a | |||
注:ADL为日常生活活动能力;超早期1例、早期组2例,于术后14天后放弃治疗死亡病例
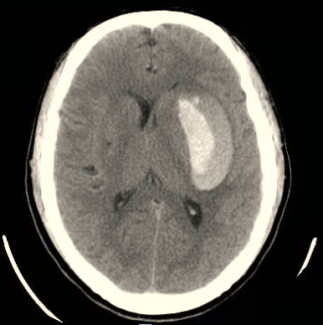
1
2
3


男性,43岁,突发右侧肢体不利3小时入院;1:术前出血量约42ml,为混合
型血肿;2:早期手术,引流4天后血肿少许残留,准备拔管;3:术后1周,拔管
后复查,血肿基本清除。
图1 经额微创穿刺术治疗基底节区脑出血
3 讨论
高血压性基底节脑出血是一种高致残率、高死率的疾病。随着医疗技术的不断发展,高血压性基底节脑出血患者的预后已得到明显改善[2]。若出血量>30ml,且后期出现脑组织水肿,可以危及患者生命。外科手术可以减轻血肿引起的占位效应及凝血块释放各种毒性物质导致继发性脑组织损害。对于伴有神经功能进行性恶化的患者尽快行颅内血肿清除术,已经得到了更多认可[3]。对于中等量基底节脑出血患者,在治疗方式尤其是手术方式和时机的选择上仍有很多分支。
高血压脑出血好发于老年人,他们手术耐受性差,术后并发症多,病死率高。全国多中心、大样本、临床随机对照研究结果表明,治疗25-40ml基底节区血肿,采用微创血肿穿刺术与单纯内科保守治疗比较,可明显改善患者日常生活活动能力[4]。微创血肿穿刺术术中创伤小,手术时间短,术后恢复快,老年人更容易耐受[5]。该术式的并发症主要为再出血和颅内感染,降低再出血率和颅内感染率成为治疗成败的关键。本研究回顾性分析104例中等量基底节脑出血患者临床资料,延期组患者再出血率和颅内感染率均最低,术后14天ADL分级,延期组和早期组患者显著优于超早期组患者,而术后3月ADL分级延期组略优于早期组和超早期组,但3组差异无统计学意义。Hanley
[6]等进行的一项多中心、随机性临床试验显示发病48小时后行微创血肿穿刺术的患者可以从手术中获益。
脑出血超早期颅内血肿尚不稳定,约80%患者于发病6小时内出现不同程度的血肿扩大[7],且血肿的占位效应有利于压迫破裂的血管起到止血作用,血肿腔存在多个出血点,手术操作也可能形成新的出血点,此阶段手术术后再出血的概率增加[8]。微创血肿穿刺术无法在直视下操作,不能像开颅手术一样直接对出血点进行处理,血肿迅速扩张对周围脑组织造成不可逆的损伤,直接影响手术效果和患者的预后。本组超早期手术组共6例(18.8%)再出血病例,2例因血肿量较大中转行开颅手术。早期手术组共4例(9.1%)再出血病例,均发生在病后24小时内。延期手术组无再出血病例。
研究表明急症手术和颅内引流管留置时间长是手术后颅内感染的危险因素,针对不同危险因素采取相应的预防措施可以降低手术后颅内感染的发生率[9]。宫剑等研究显示留置引流管3天以内无感染病例,留置4天以上开始出现感染病例,并呈波浪式上升[10]。本组3组病例患者术后保留引流管时间和血肿腔注射尿激酶次数差异有统计学意义,其中延期手术组患者引流时间最短(3.1±1.4天),血肿腔注入尿激酶次数最少(3.2±3.5次)。同时延期组颅内感染率最低,差异有统计学意义。引流时间与血肿的物理状态密切相关,延期手术组患者引流时间较短可能与该时间窗口血凝块处于部分液化状态有关[11]。另有文献[12]显示,颅脑引流管拔除相关的出血为21.9%,长时间留置引流管,发生拔除相关出血的风险较高[10]。笔者的经验是对于液化型和混合型血肿即使早期(6-48小时)手术,也可获得较好的引流效果,见图1。残余血肿体积﹤10ml,即可拔除引流管,微创血肿穿刺术中过度追求较高的血肿清除率,会因引流管留置时间过长或机械性损伤等因素,造成拔除引流管相关的出血。
对于高血压性脑出血,迄今为止没有公认的最佳手术方式及手术时机。微创血肿穿刺术在治疗脑出血患者中发挥着重要作用。手术时机也应依照患者的具体病情,个体化选择。本研究结果表明,微创血肿穿刺术是一种治疗中等量基底节血肿的创伤小、预后较好的方法。发病6小时后手术可获得较好的近远期疗效,对于意识清楚、血肿体积较小的患者,延迟手术至发病48小时后可降低患者的再出血率、颅内感染率,获得最优的手术效果。
参考文献
[1] Ding D,Przybylowski CJ,Starke RM,etal.Aminimally invasive anterior skull base approach for vacuation of a basal ganglia hemorrhage[J],J Clin Neurosci,2015,22(11):1816-1819.DOI:10.1016/j.jocn.2015.03.052.
[2] 石晓勇,麻江春,刘伟贤,等.不同手术方法治疗老年高血压性脑出血患者的疗效分析[J].中华神经外科杂志,2020,36(7):703-705.
[3] 路楷,徐彬彬,查海峰,等.高血压脑出血外科治疗与预后的相关性分析[J].中华神经外科疾病研究杂志,2014,13(4):354-356.
[4] 胡长林, 吕涌涛, 李志超. 颅内血肿微创穿刺清除技术规范[M]. 北京: 人民卫生出版社, 2014: 100-138.
[5] 阿布都克尤木·阿布都吉力力,麦麦提依明·托合提,帕热哈提江·依孜木,等. 不同手术时机及手术方式治疗高血压性基底节区出血的疗效对比研究[J].中华神经外科杂志,2017,33(4):354-357.
[6] Hanley DF, Thompson RE, Muschelli J, etal.Safety and efficacy of minimally invasive surgery plus alteplase in intracerebral haemorrhage evacuation (MISTIE):a randomised, controlled, open-label, phase 2 trial[J].Lancet Neurol, 2016, 15:1228⁃1237.
[7] Keep RF, Hua Y, Xi G. Intracerebral haemorrhage:mechanisms of injury and therapeutic targets[J]. Lancet Neurol, 2012, 11:720⁃731.
[8] 张同星.不同手术时机对高血压脑出血患者神经功能及预后的影响[J].宁夏医科大学学报,2020,42(2):186-189.
[9] 高岸英,李燕,王永胜.清洁切口颅脑手术后并发颅内感染相关因素分析[J].中华医院感染学杂志,2011,21(17):3581-3582.
[10] 王振民,宫剑.儿童开颅术后脑脊液外引流与颅内感染的相关性研究[J].首都医科大学学报,2021,42(2):269-272.
[11] 孙世航,刘波,谢才兰.高血压脑出血的血肿物理状态与手术策略[J].中外医学研究,2016,14(26):12-13.
[12] Miller C,Guillaume D. Incidence of hemorrhage in the pediatric population with placement and removal of externalventricular drains[J].J Neurosurg Pediatr,2015,16(6):
662-667.