天然药物活性组分与功效国家重点实验室(中国药科大学),南京 210009
摘要:五环三萜在植物中广泛分布,因其结构多样性和广泛的生物活性而倍受关注。但是,这类化合物普遍存在着水溶性差、生物利用度低等缺陷,导致其临床试验和广泛应用屡屡受挫。许多研究人员致力于通过结构修饰改善其性质,但这类化合物的骨架上活泼基团较少,因此化学修饰的反应位点十分有限。生物转化作为一种新兴的结构修饰方法异军突起。生物转化,亦称为生物催化,是指利用生物体系(包括真菌、细菌、植物离体培养细胞、组织或器官和动物细胞等)对外源性化合物进行结构修饰的生物化学过程。不同于化学合成中苛刻的反应条件,有限的活泼位点,生物催化可以在低污染、低能耗、高特异性的条件下进行,只通过一步催化反应就可以产生结构各异的化合物,尤其是非活泼 C-H 键的活化,反应位点众多,产物结构新颖,为五环三萜类药物开发提供了大量候选化合物。本文综述了齐墩果烷型五环三萜类化合物的生物转化研究进展,为五环三萜的结构修饰和新药开发提供依据和参考。
关键词:五环三萜,齐墩果烷型,生物转化,结构修饰
Research progress on biotransformation of oleanane type pentacyclic triterpenoids
Zhu yuyuan, Zhang jian*
State Key Laboratory of Natural Medicines, China Pharmaceutical University, Nanjing 210009, China.
Abstract: Pentacyclic triterpenoids are widely distributed in plants, attracting much attention due to their structural persity and wide range of biological activities. However, pentacyclic triterpenoids have some defects, such as poor water solubility and low bioavailability, which lead to many setbacks in their clinical trials and wide application. Many researchers have tried to improve the properties of these compounds by structural modification, but due to the few active groups on the skeleton, the reaction sites for chemical modification are very limited. Biotransformation, also called biological catalysis, emerged as a new structural modification method. Biotransformation uses biological systems (including fungi, bacteria, plants in vitro culture cell, tissue or organs and animal cells, etc.) to modify exogenous compounds during a biochemical process. Different from the harsh reaction conditions and limited active sites in chemical synthesis, biotransformation can be carried out under mild conditions of low pollution, low energy consumption and high specificity. Compounds with various structures can be produced through only one step of catalytic reaction, especially the activation of inactive C-H bonds. The biotransformation provides a large number of candidate compounds for the development of drugs of pentacyclic triterpenoids. In this paper, the progress of biotransformation olanolane type pentacyclic triterpenoids are reviewed, which will provide basis and reference for structural modification of pentacyclic triterpenoids and development of new drugs.
Key words: pentacyclic triterpenoids, oleanane type, biotransformation, structural modification
五环三萜(Pentacyclic triterpenoids)是一类由30个碳原子组成的萜类化合物,从结构类型来看主要分为齐墩果烷(oleanane)型、乌苏烷(ursane)型及羽扇豆烷(lupane)型这三大类。五环三萜在自然界分布广泛,具有抗肿瘤、抗炎、抗心血管疾病、抗病毒、保肝等多种生物活性[1, 2],是一类重要的天然活性物质,天然来源的五环三萜的结构多样性为新药开发提供了许多素材,但天然产物普遍存在生物活性广而不强,生物利用度低等问题,因此研究者们对天然五环三萜进行大量的结构修饰研究,对获得的衍生物进行各种药效学评价,以期发现某些药理活性增强的候选化合物。目前大多数研究者选择的结构修饰的五环三萜底物如齐墩果酸、山楂酸、积雪草酸等等往往是自然界中量大而易得的五环三萜,并且传统化学修饰主要针对它们骨架上的有限的几个活泼基团(如C-3羟基或C-28羧基等),选择性的缀连不同取代基团实现结构多样性,只有少数研究通过重金属催化剂等比较苛刻复杂的反应条件将反应位点扩展到活性基团邻近的非活性碳,而对其余大多数非活泼位点C-H键的修饰十分困难。但是仅通过对常见五环三萜分子的局部取代修饰,也无法对五环三萜发挥药理学作用的关键活性基团或是结构域进行准确的判断。因此,近年来越来越多的学者采用微生物转化的方法来丰富该类化合物的结构多样性。
生物转化(biotransformation),亦称为生物催化(biocatalysis),是指利用生物体系(包括真菌、细菌、植物离体培养细胞、组织或器官和动物细胞等)或其产生的酶制剂对外源性化合物进行结构修饰的生物化学过程。相比于化学合成中繁琐的反应途径,苛刻的反应条件,并且反应位点多限于原骨架中的活泼部位,如以齐墩果酸为例,绝大多数结构修饰均是围绕 C-3 羟基、C-28 羧基或是C环的双键,反应类型多为 C 环双键的重排、氧化或成酯、酰胺等。而生物催化可以在低污染、低能耗、高特异性的条件下进行,只通过一步催化反应就可以产生结构多样性的化合物,尤其是非活泼C-H 键的活化,例如各个非活泼C-H键的羟基化,C-28的羧基或羟基环氧化与糖基化等等。
此外,生物转化具有区域选择性高、立体选择性强和反应类型众多等特点,减少了化学催化中可能产生的分子异构化、消旋化、差相异构化和重排等问题,进而为新药研发提供了更有价值的先导化合物。由于体内肠道菌群对药物的代谢也属于生物转化的范畴,因此采用微生物转化来对五环三萜进行结构修饰还可以辅助探索该类化合物在体内代谢和发挥药理活性的物质基础。齐墩果烷型(oleanane)五环三萜,基本骨架特征是β-香树脂烷,其E环的两个角甲基都位于C-20上。代表性常见天然化合物有齐墩果酸,高根二醇,山楂酸,常春藤皂苷元,甘草次酸,刺囊酸等。本文主要概述目前对于齐墩果烷型五环三萜的生物转化研究进展。
齐墩果酸的生物转化
齐墩果酸(Oleanolic acid,化合物1)是齐墩果烷型代表化合物,在植物界分布广泛,如夏枯草、女贞子、连翘、白花蛇舌草等传统中药中均有分布。早在20世纪70年代研究工作者证实它能降低谷丙转氨酶活性,促进肝细胞再生,具有良好的肝保护功能,临床上用于急慢性肝炎的辅助治疗。近年来,研究者对其抗肿瘤活性进行了大量研究,发现齐墩果酸及衍生物对肺癌、肝癌、乳腺癌、卵巢癌等多种不同类型癌细胞均具有良好的细胞毒性[3]。但由于齐墩果酸的生物利用度低,限制了其临床应用,鉴于齐墩果酸显著的抗肿瘤活性,对其进行结构修饰来寻找生物利用度高、药效更好、毒性更低的衍生物已经是近十年来的研究热点。生物转化不仅可以满足对其结构修饰的要求,还能使反应在绿色环保的条件下一步完成,并且反应位点常发生在不活泼的部位,这也弥补了化学合成中的不足,成为研究的热点因其易于获得且有多篇研究报道其活性,研究者们以其为底物进行了生物转化研究。
Hikino等人对五环三萜进行了生物转化,利用菌株 Fusarium lini 转化得到 4个产物[4](化合物1-5),反应类型包括 C-15 α-羟基化、C-11羰基化、C-12 羟基化的13(28) 内酯环化、共轭双烯(图1),利用 Cunninghamella blakesleeana 转化得到6个产物[5](化合物4-9),与上一菌株产物以及反应类型有所重合,另外还发生了C-1、C-7 β-羟基化以及C-28内酯环化(图2)。
图1 Fusarium lini对齐墩果酸的生物转化

图2 Cunninghamella blakesleeana对齐墩果酸的生物转化
Gong等人采用Trichothecium roseum对齐墩果酸进行生物转化研究,得到两种代谢产物[6] (化合物10和11),这两种产物的 C-3 位羟基均被氧化成羰基,15位引入α-羟基。此外,化合物11还具有7β羟基,催化类型主要为羟基化反应(图3)。

图3 Trichothecium roseum对齐墩果酸的生物转化
2. 高根二醇的生物转化
高根二醇(Erythrodiol,化合物12)是一种天然的五环三萜二醇,广泛存在于膳食植物中,尤其在橄榄的果实和叶子中含量丰富。近几十年来,人们对橄榄油的兴趣日益浓厚,而榨取油脂后的橄榄渣含有大量包括高根二醇在内的五环三萜,为了有效利用这些残渣并扩大三萜的结构多样性,Shen等人使用三种不同的菌株对高根二醇进行生物转化,共计获得了11个衍生物(化合物13-23)并在LPS刺激的RAW264.7 细胞株上测定了一氧化氮抑制率来评估其抗炎活性[7],反应类型包括选择性羟基化,角甲基氧化羧基化,糖基化和羰基化(图4,5,6)。抗炎活性数据显示,C-28位的糖基化产物化合物23的IC50甚至低于阳性药槲皮素,证明了其在药物开发中的潜力。

图4 Streptomyces griseus 对高根二醇的生物转化
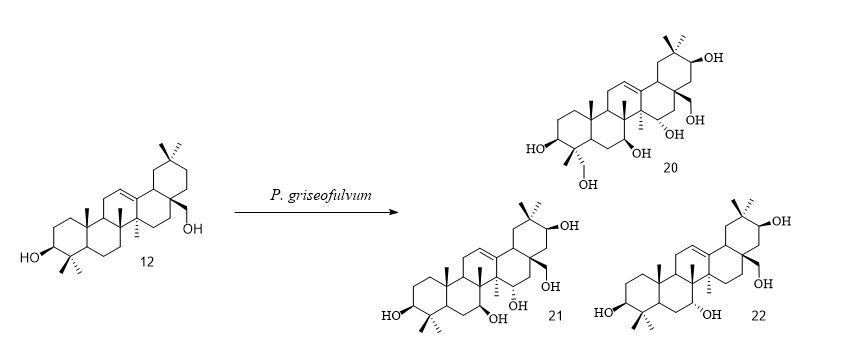
图5 Penicilium griseofulvum 对高根二醇的生物转化

图6 Bacillus subtilis 对高根二醇的生物转化
3. 山楂酸的生物转化
山楂酸(Maslinic acid,化合物24),又称马斯里酸,是一种天然的五环三萜,存在于多种天然来源中,包括中草药[8]、食用蔬菜和水果[9],尤其是橄榄皮中。山楂酸的药理作用已在各种实验模型中报道,包括抗肿瘤、抗炎、保护心脏、抗病毒、抗疟疾、神经保护和抗氧化的活性。鉴于山楂酸具有如此广泛的生物活性,以此为底物进行的微生物转化研究越来越得到了许多科研工作者的关注。
Martinez等人用Rhizomucor miehei对山楂酸进行生物转化,得到两个代谢产物[10]化合物25,26,化合物25为C-13羟基化后与C-28 位的羧基形成的环状内酯,化合物26是C-30位羟基化得到的产物(图7)。

图7 Rhizomucor miehei对山楂酸的生物转化
Feng 等人采用 Cunninghamella blakesleeana CGMCC 3.910对山楂酸进行结构改造,得到4种羟基化产物[11](化合物27-30)。分别为 7β-羟基-山楂酸,15α-羟基-山楂酸,7β, 15α-二羟基-山楂酸和 7β, 13β-二羟基-11-烯山楂酸,反应类型主要为选择性的羟基化反应 (图8)。

图8 Cunninghamella blakesleeana对山楂酸的生物转化
5. 结语与展望
五环三萜化合物是一类具有多种活性的天然产物,是药物开发先导骨架以及候选化合物的重要来源。为了实现五环三萜的结构多样性,目前主要有天然分离,化学合成以及生物转化三种途径。鉴于天然分离及化学合成的局限性,生物转化对五环三萜的结构修饰具有重要意义,本论文总结了近年来齐墩果烷型五环三萜的生物转化文献,可以发现生物转化能够快速,高效地丰富五环三萜结构多样性,产生的反应的主要类型多为氧化反应,其中非活泼C-H键的羟基化最为常见。同时,研究中还指出五环三萜的生物转化产物可以具有强大的药理活性,这让我们坚信生物转化对于五环三萜的意义,为后续的工作提供了借鉴。
参考文献
[1] Kang H, Ku SK, Kim J, et al. Anti-vascular inflammatory effects of pentacyclic triterpenoids from Astilbe rivularis in vitro and in vivo [J]. 2017,
[2] Romero-Estrada A, Maldonado-Maga?A A, González-Christen J, et al. Anti-inflammatory and antioxidative effects of six pentacyclic triterpenes isolated from the Mexican copal resin of Bursera copallifera [J]. 2016, 16(1): 422.
[3] Shanmugam MK, Dai X, Kumar AP, et al. Oleanolic acid and its synthetic derivatives for the prevention and therapy of cancer: Preclinical and clinical evidence [J]. 2014, 346(2): 206-16.
[4] Hikino H, Nabetani S, Takemoto TJYzjotPSoJ. Microbial Transformation of Oleanolic Acid. (1) [J]. 1969, 89(6): 809-13.
[5] Hikino H, Nabetani S, Takemoto TJYzjotPSoJ. Microbial transformation of oleanolic acid. (II) (Japanese) [J]. 1971, 91(6): 637-40.
[6] Gong T, Zheng L, Zhen X, et al. Microbial transformation of oleanolic acid by Trichothecium roseum [J]. 2014, 16(4): 383-6.
[7] Shen P, Wang W, Xu S, et al. Biotransformation of Erythrodiol for New Food Supplements with Anti-Inflammatory Properties [J]. J Agric Food Chem, 2020, 68(21): 5910-6.
[8] Xu HX, Zeng FQ, Wan M, et al. Anti-HIV Triterpene Acids from Geum japonicum [J]. 1996, 59(7): 643-5.
[9] Kalogeropoulos N, Chiou A, Ioannou M, et al. Nutritional evaluation and bioactive microconstituents (phytosterols, tocopherols, polyphenols, triterpenic acids) in cooked dry legumes usually consumed in the Mediterranean countries [J]. 2010, 121(3): 682-90.
[10] Martinez A, Perojil A, Rivas F, et al. Biotransformation of oleanolic and maslinic methyl esters by Rhizomucor miehei CECT 2749 [J]. 2015, 117(500-8.
[11] Xu F, Jie L, Fei FG, et al. Microbial transformation of maslinic acid by Cunninghamella blakesleana [J]. 2012, 82(127-30.