贵州医科大学附属医院产前诊断中心超声部,贵州 贵阳 558000
【关键词】产前超声;胎儿;肠闭锁
孕妇,37岁,孕2产1,妊娠期糖尿病,孕期未行特殊处理,否认孕期用药史及有毒物接触史。因高龄行羊膜腔穿刺,结果回示阴性。已育有一男,现10岁体健。孕22+6周行胎儿产前系统超声检查,结果提示:胎儿肠管回声增强,左下腹局部肠管扩张,内径最宽处宽约0.7cm,未探及腹腔积液,羊水指数14.34cm。孕25+5周行胎儿产前常规超声检查,结果提示:胎儿肠管回声增强,左下腹局部肠管扩张,内径最宽处宽约1.4cm,未探及腹腔积液,羊水指数14.67cm。孕32+4周行胎儿产前系统超声检查,结果提示:胎儿腹腔内肠管全程扩张呈“渔网状”,内径最宽处宽约2.12cm,未探及腹腔积液,羊水指数24.25cm。超声诊断:先天性小肠闭锁或狭窄可能(图1)。

图1 胎儿产前超声肠管扩张声像图 A.孕22+6周;B.孕25+5周;C&D.孕32+4周
孕妇孕34+1周因“胎膜早破”入院,胎儿臀位,遂行剖宫产娩出一女婴,Apgar评分9-10分/1-5分钟,羊水、脐带、胎盘组织无特殊异常,新生儿出生体重2320g。出生后患儿偶吐唾沫,查体见腹胀,肠型及蠕动波明显,肠鸣音3-4次/分,高亢,未排胎便。肛门指检:小指进入肛门可通过肛门口,但继续深入感前方肠管有阻挡不能通过,退出手指上可见粘液样物质附着,伴血色。腹部床旁正位片提示:结肠扩张、积气(图2-A)。下消化道碘水造影检查提示:钡灌肠显影段肠管未见明显梗阻征象(图2-B)。结合患儿多次产前超声检查提示、患儿出生后的临床症状和体征以及产后各项辅助检查,考虑下消化道畸形可能。
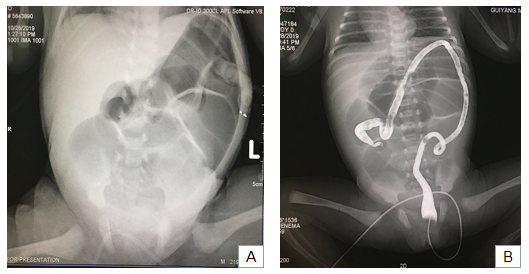
图2 患儿产后腹部声像图 A.腹部床旁正位片 B.下消化道碘水造影检查
结合患儿病史,完善相关检查,排出手术禁忌后立即在全麻下行“开腹探查+肠切除+肠吻合+肠内减压+肠造瘘术”。术中探查肠管见:距屈氏韧带60cm处可见空肠肠管扩张明显,扩张下段有一肠管闭锁;距屈氏韧带75cm处可见第二处肠管闭锁,远端肠管呈胎儿肠管。打开第一处肠管隔膜,排空肠内容物行肠内减压。打开第二处肠管隔膜向远端肠管内注水,查看肠管通畅,水流顺利进入结肠,遂将两处闭锁肠管切除。因近端肠管增粗明显、远端肠管呈胎儿肠管,两端吻合困难,遂将近端肠管及远端肠管均拉出皮肤行肠造瘘,近端肠管于左下腹经皮肤穿出固定,远端肠管于切口右侧边缘拉出固定。术中诊断为先天性空肠闭锁。

图3 开腹探查术中见肠管闭锁
讨论 先天性小肠闭锁是由于小肠管腔内出现隔膜或患病节段部分或完全闭锁,其病因可能与胚胎发育过程中小肠再通障碍及肠壁血管缺血缺氧,从而使肠管发生无菌性坏死、吸收、修复等复杂病理生理过程而造成[1,2]。胎儿肠道任何部位均可发生闭锁,但最多见于回肠和空肠下部(36%~43%),其次是十二指肠和空肠近端(37%)[3]。病灶可呈单发或多发,是新生儿肠梗阻的常见原因之一。新生儿先天性肠闭锁发病率约为1/5000,发达国家存活率可高达90%以上,而发展中国家存活率约为58.3%-71.5%[4]。
目前有研究表明新生儿多发性肠闭锁是由于四反转录肽重复域7A (TTC7A)基因的常染色体隐性突变所致,通常合并严重联合性免疫缺陷[5,6];也有研究表明ITGAV、2q31-q32、PMSI、FGF10等基因突变和染色体易位均可导致多发性肠闭锁的发生[7]。这些研究给既往有先天性肠闭锁不良孕产史的家庭提供了基因学研究的方向,而先天性肠闭锁的发病机制、产前诊断以及干预方式的也成为目前肠闭锁的研究重点。
临床上通常采用病理分型Grosfeld改良法[8]对小肠闭锁进行分型:I型:隔膜闭锁,肠壁及肠系膜完整;Il型:盲端闭锁,两盲端由纤维索带连接,肠系膜完整;IIIa型:盲端闭锁,肠系膜分离;IIIb型:苹果皮样闭锁(Apple-Peel闭锁);IV型:多发性闭锁。多发闭锁可呈I、II、IIIa型同时并存,闭锁部位及数目不等。但在产前超声工作中我们很难做到病理分型,通过胎儿声像图表现和小肠在腹腔内的投影位置可提示小肠闭锁区域的是空肠还或回肠闭锁[9]。
胎儿肠闭锁在早孕期或中孕早期超声表现不明显,一般在孕24周以后才出现较为显著的特征,闭锁的上段肠管表现为扩张,而闭锁的下段肠管可出现不同程度的狭窄[1],肠管的扩张程度随孕周增加而增加。中孕期或晚孕早期胎儿小肠蠕动增加,扩张肠管直径一般大于7mm。孕中期羊水一般在正常范围内,而孕晚期由于肠闭锁导致肠液循环障碍而使羊水运转受阻、胎儿吞食和吸收羊水较少等原因通常会出现羊水过多,肠管梗阻部位越高,羊水过多的表现就越明显
[9]。通过产前超声提示肠管扩张及羊水增多可初步诊断肠道闭锁,并根据肠管扩张的区域初步判断梗阻的部位,出生后可通过临床表现、腹部平片、腹部CT、消化道造影等进一步诊断,而明确诊断是否为多发性肠闭锁则需通过术中探查证实[10]。
鉴别诊断 先天性小肠闭锁的病理类型多样,产前超声很难做到具体分型,而先天性失氯性腹泻综合征的胎儿产前超声也表现为肠管扩张、妊娠后期羊水过多,产后不久出现水样便、低氯血症、低钾血症以及代谢性碱中毒等一系列临床表现,是一种家族性常染色体隐性遗传病[11]。因其相似的产前超声表现,部分先天性失氯性腹泻综合征可误诊为先天性小肠闭锁。
意义 先天性小肠闭锁是新生儿肠梗阻的常见原因,严重威胁患儿的生命。本例新生儿的产前超声已多次提示胎儿肠道扩张及羊水增多,高度怀疑肠道闭锁,产后立即完善相关检查并及早手术治疗,术后患儿恢复尚可。先天性小肠闭锁的早诊断及早治疗是挽救患儿生命、提高患儿生存质量的关键。产前超声具有简便性、安全性、无创性、实时性及可重复性等特点,可作为诊断胎儿先天性肠闭锁或狭窄的首选筛查方法。
【参考文献】
谢红宁,何苗. 胎儿消化道发育异常的超声评估及其临床预后[J]. 实用妇产科杂志, 2017,33(12):891-894.
陈萍,缪仕华,陈秀伦. B超诊断胎儿小肠闭锁[J].中国超声医学杂志, 2003,19(9):711-712.
余志红,王慧芳, 林琪. 中孕期胎儿超声筛查切面的规范化探讨[J].中华超声仪像学杂志, 2005, 14(1):39.
Shilpi Gupta,Rahul Gupta,et al. Intestinal Atresia: Experience at a Busy Center of North-West India[J]. Journal of Neonatal Surgery, 2016, 5(4): 51.
Niti Sardana Agarwal, Lesley Northrop,et al. Tetratricopeptide Repeat Domain 7A (TTC7A) Mutation in a Newborn with Multiple Intestinal Atresia and Combined Immunodeficiency[J].Journal of Clinical Immunology, 2014,34(6):607-610.
Jessica R. Saunders, Anna Lehman,et al. Novel Exonic Deletions in TTC7A in a Newborn with Multiple Intestinal Atresia and Combined Immunodeficiency[J].Journal of clinical immunology, 2019,39(6):616-619.
袁晨东,金先庆. 多发性肠闭锁的研究进展[J]. 临床小儿外科杂志 ,2012, 11(3):222- 224.
李正, 王慧贞, 吉士俊. 实用小儿外科学[M] 北京:人民卫生出版社, 2001:703-704.
蒋健穗, 梁彪. 胎儿小肠闭锁的超声表现及临床意义[J].广西医科大学学报, 2005, 22(1):102.
桂琳玲, 鲁巍. 新生儿多发性肠闭锁的治疗及预后分析[J].实用医学杂志, 2019, 35(1):167-168.
Kere J, Lohi H, Hoglund P.Genetic Disorders of Membrane Transport Ⅲ. Congenital chloride diarrhea[J]. Am J Physiol,1999, 276(1 Pt 1):G7-G13.
作者简介及联系方式:
莫有敏,女,贵州医科大学附属医院产前诊断中心超声部,主治医师。
通信地址:贵州省贵阳市云岩区北京东路未来方舟F11组团3栋15楼4号。
邮编:558000
电话:15885023087
电子邮箱:674672862@qq.com