摘要:目的:探讨LncRNA-HOXB9-206在喉鳞状细胞癌中的表达及临床意义。方法: 利用基因芯片技术和实时定量PCR(qRT-PCR)检测喉鳞状细胞癌组织及癌旁正常组织中LncRNA-HOXB9-206的表达情况,分析其表达水平与临床病理特征的相关性。结果: LncRNA-HOXB9-206在喉癌组织中表达水平较高(𝑃<0.01),表达水平与性别、年龄、发病部位无关,与临床分期、T分级、淋巴结转移及病理学分级(𝑃<0.05)相关。结论:与癌旁正常组织相比,LncRNA-HOXB9-206在喉癌组织中高表达,可能与喉癌的发生发展有关。
关键词: 长链非编码RNA; HOXB9-206;喉癌
喉鳞状细胞癌(LSCC)是高度侵袭性癌症的最常见形式之一,并发生于头颈部恶性肿瘤[1]。 目前国内外多采用综合疗法,以手术治疗为主,放化疗及生物学治疗为辅的原则。虽然,此疗法对早期病例效果尚可,但对中晚期病例效果较差。使得喉癌患者的五年整体存活率仍然不高 [2]。 喉癌依然是世界范围内死亡的主要原因之一,严重威胁着人类的健康和生命。因此,明确喉癌发生发展的分子机制,寻找喉癌早期诊断及预警的分子标志物,在分子水平寻求新的治疗手段成为当前亟需解决的问题。对于挽救喉癌患者生命和维护人类健康具有重大的理论与实际意义。
长链非编码RNA(long non-coding RNA,lncRNA)是一类不编码蛋白质,但在细胞中起重要调控作用的RNA分子,其长度介于200~100000 nt之间,参与染色体修饰、染色质沉默、转录激活、转录干扰、转录后调控、蛋白质翻译调节以及 miRNA 功能调节等方面[3-5]。文献报道lncRNA :HOTAIR、 NEAT1和H19在喉癌的发生、发展中发挥重要作用。其中发现HOTAIR隶属于HOX基因家族。目前,学术界对于HOX基因家族的研究处于起步阶段。
HOX基因又名Ⅰ型同源异形盒基因,是一类进化上高度保守的多基因家族,分为A、B、C、D四个簇,每簇包含9-11个基因,编码一组十分重要的生长调节因子和转录调节因子,据报道,HOX基因在正常的胚胎发育,细胞分化以及真核细胞生命中的其他过程中起着至关重要的作用[6]。 一些研究发现,许多HOX基因在肿瘤转化和肿瘤进展中起重要作用[7,8]。已发现HOX基因在许多肿瘤中异常表达,例如乳腺癌[9,10],白血病[11,12],肺[13,14],肝[15]和胃癌[16]。 基于lncRNA及HOX基因在喉癌中的研究,我们设想,在喉癌发生发展过程中是否存在其他的HOX基因转录的LncRNA的异常表达?如是,异常表达的LncRNA对喉癌的发生发展起到了什么样的作用?其机制是什么?
为此,我们利用基因芯片技术研究了HOX基因转录的LncRNA在喉癌中的表达谱,从中选择了高表达的LncRNA-HOXB9-206进一步研究,运用qRT-PCR 技术验证其在喉癌中的表达水平, 探讨其表达水平与喉癌临床病理参数的关系。
材料与方法
1.一般资料:选取哈尔滨医科大学附属第二医院耳鼻喉头颈外科2014年1月~2014年5月手术切除的50例喉鳞癌组织标本及癌旁正常组织为实验样本。其中5例用于基因芯片实验,45例用于qRT-PCR实验。所有病例均为经病理确诊的初发喉鳞癌患者,并且全身检查均未发现远处肿瘤转移,术前都未施行放疗、化疗或其它方法治疗。本试验所有选取的实验组喉鳞癌组织标本及癌旁正常组织样本的收集均征得患者同意,患者本人签署知情同意书。选择美国Arraystar公司提供的8 x 60K Human LncRNA Microarray 2.0 版芯片,此芯片收录了目前最全的LncRNA,杂交实验可以检测LncRNA的表达水平。
2.总RNA的抽提与质检:按着Trizol试剂盒分别提取50例喉癌组织及癌旁正常组织中的RNA,使用NanoDropND-1000型紫外分光光度计测定组织总RNA纯度,并做进一步的RNA完整性检测:琼脂糖凝胶电泳质检。
3.cRNA合成,标记,与杂交反应:利用Agilent公司提供的逆转录试剂盒及单色标记试剂盒,合成标记cRNA,通过使用紫外分光光度计检测荧光标记率,后利用Agilent公司提供的杂交系统进行杂交反应。
4.芯片扫描及数据分析:采用Agilent Scanner G2505C扫描仪进行扫描芯片,单色扫描后将图像导入图像分析软件(安捷伦特征提取软件),经过排列,提取得到基因表达的荧光信号强度值,应用计算机软件进行标准化处理分析。获得标准化的芯片表达数据,再把数据输入到Agilent GeneSpring GX软件(version 11.5.1)进行分析,图像定量和标准化数据处理,按Fold Change≧2.0, P-value≦0.05值筛选,筛选出差异表达LncRNA数据。
5. qRT-PCR检测:利用东洋纺公司的ReverTra Ace qPCR RT Kit将RNA逆转录为cDNA。按着说明书,利用SYBR Green Realtime PCR Master Mix试剂盒进行扩增,以18s作为内参基因,LncRNA-HOXB9-206相对表达使用2-ΔΔCt计算。
6.统计分析:使用SPSS 22.0统计软件,计数资料以例表示,利用多因素方差分析和t检验分析LncRNA-HOXB9-206与临床病理特征的关系,P值小于0.05认为具有统计学意义。
结 果
经过计算机数据分析,我们获得到HOX基因转录的LncRNA表达数据,按着差异表达的标准:Foldchange≧ 2.0 P-value ≦ 0.05筛选得到差异表达的HOX基因簇的LncRNA有18条,表达上调的有8条:HOXA4-66、HOXA10-82、HOXA11-86、HOXA13-100、HOXB9-206、HOXB9-205、HOXD12-3、HOTAIR。HOXB9-206 (P<0.01,Foldchange:12.83),表达下调的有10条:HOXA11-92、HOXA13-97、HOXB4-171、HOXB4-173、HOXB9-187、HOXC5-254、HOXC9-131、HOXC11-114、HOXD1-49、HOXD9-16。(见图1)

图1: microarray结果显示喉癌中差异表达HOX基因的lncRNA
qRT-PCR验证了基因芯片的结果,LncRNA-HOXB9-206在LSCC和癌旁正常组织之间显示出显著差异(𝑃<0.01)。(见图2)此外,发现LncRNA-HOXB9-206的表达水平与LSCC的临床分期、T分级、淋巴结转移及病理学分级(𝑃<0.05)相关。(见表1)
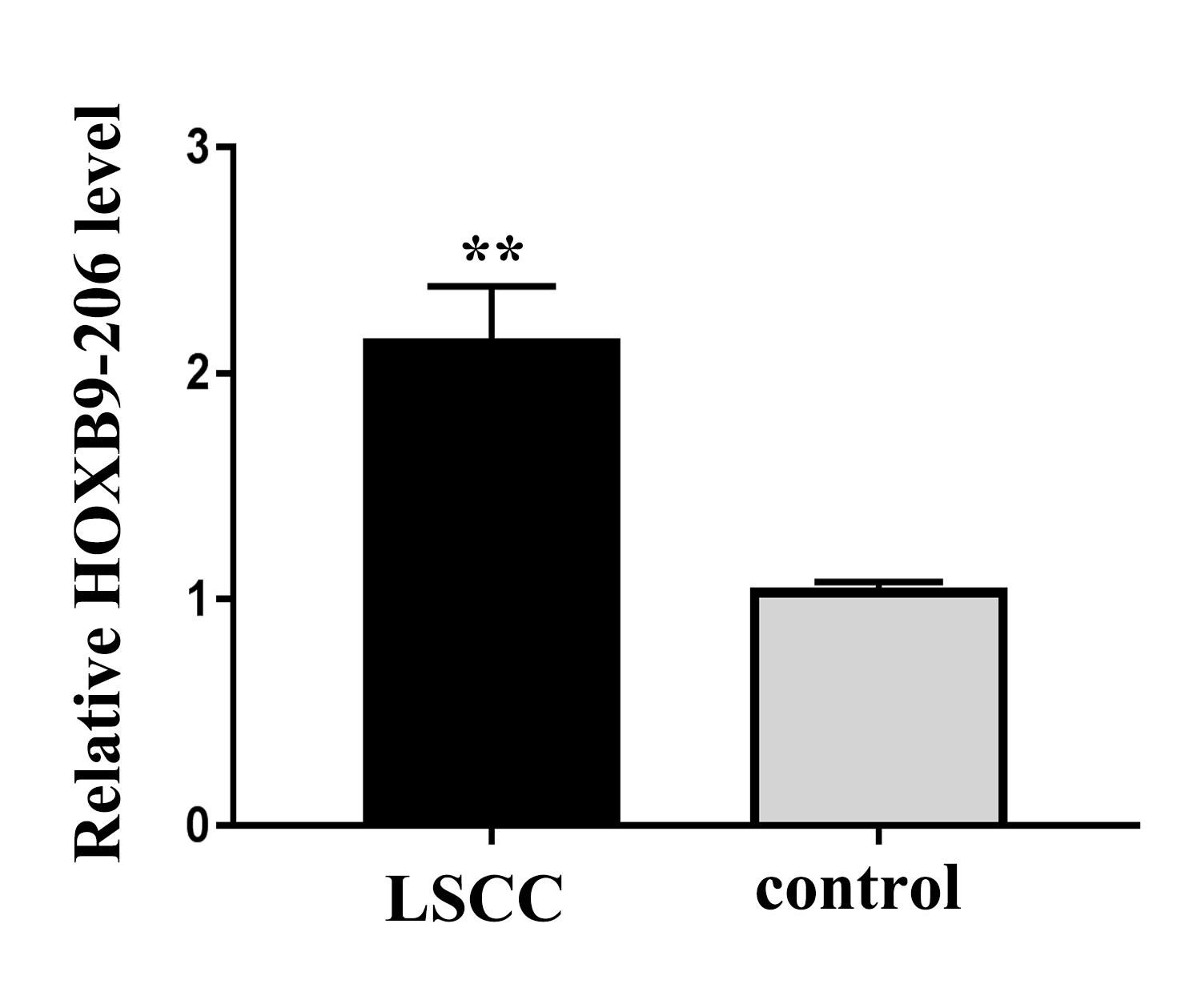
图2 HOXB9-206在喉癌组织中的表达显著高于对照组(𝑃<0.01)
表1 HOXB9-206表达水平与喉癌临床病理参数的关系 例(%)
项目 (例数) | HOXB9-206 | 𝑃值 | |
高表达 低表达 | |||
性别 | | | 0.835 |
男(25) | 13(52.00) | 12(48.00) | |
女 (20) | 12(60.00) | 8(40.00) | |
年龄 | | | 0.351 |
≥60 (27) | 17(62.96) | 10(37.04) | |
﹤60(18) | 10(55.56) | 8(44.44) | |
T 分级 | | | 0.021 |
T1-2 (20) | 9(45.00) | 11(55.00) | |
T3-4 (25) | 17(68.00) | 8(32.00) | |
病理学分级 | | | 0.016 |
G1 (26) | 12(46.15) | 14(53.85) | |
G2 (19) | 16(84.21) | 3(15.79) | |
淋巴结转移 | | | 0.023 |
无 (27) | 10(37.04) | 17(62.96) | |
有 (18) | 12(66.67) | 6(33.33) | |
发病部位 | | | 0.312 |
声门上区 (15) | 5(33.33) | 10(66.67) | |
声门区(30) | 21(70.00) | 9(30.00) | |
临床分期 | | | 0.013 |
I-II (19) | 5(26.32) | 14(73.68) | |
III-IV (26) | 20(76.92) | 6(23.08) | |
讨 论
这些HOX基因簇的LncRNA在喉癌组织中差异表达,提示它们可能参与了喉癌的发病过程,但通过何种机制来影响喉癌的发生发展,目前尚不明确。这些上调表达的HOX基因簇的LncRNA可能通过某种途径作用于原癌基因,使其激活促进肿瘤发生,同理,下调表达的基因也可能通过某种途径作用于抑癌基因,使其灭活促进肿瘤的发生。癌症的发生和转移是一个多步骤、多因素、和多基因改变的过程,其中细胞增殖失控、细胞周期调控失常和较强的侵袭性被认为是癌症发生和转移的重要机制。有研究报道,某些HOX基因簇的LncRNA调节细胞周期和细胞存活的作用可以促进细胞增殖,促进肿瘤的发生及/或发展。某些HOX基因簇的LncRNA则具有抑制细胞过度生长、繁殖从而遏制肿瘤形成的作用。在癌症中通过表观遗传机制,许多抑癌基因常被LncRNA沉默。查阅文献,目前尚未发现除HOTAIR外的上述LncRNA与喉癌有相关性报道,说明HOX基因簇的LncRNA研究是一个崭新的领域,可能发现喉癌的新的信号传导通路。
HOXB9-206位于染色体17号上(46803175-46803866),长度为大约691bp。在本研究中,LncRNA-HOXB9-206在LSCC中高表达,并与喉癌的临床分期、T分级、淋巴结转移及病理学分级相关。检索文献发现LncRNA-HOXB9-206尚无与喉癌相关功能、机制方面的报道,其可能对喉癌发生的分子机制及临床诊疗具有重要意义,需要进一步研究。据文献报道LncRNA-HOXB9-206在膀胱尿路上皮癌中低表达[17]。这一发现表明LncRNA-HOXB9-206在不同的肿瘤中变化不同,显示出组织特异性特征。
综上所述,LncRNA-HOXB9-206在喉癌组织中高表达,与喉癌的临床分期、T分级、淋巴结转移及病理学分级相关,该结果揭示了喉癌与LncRNA-HOXB9-206表达水平有密切关系。那么LncRNA-HOXB9-206在喉癌中的作用有哪些?确切作用机制是什么?这些问题都需要在下一步实验以及今后的研究工作中去探索。
参考文献
[1] E.A.ChuandY.J.Kim,“Laryngealcancer:diagnosisandpreoperative work-up,” Otolaryngologic Clinics of North America, vol.41,no.4,pp.673–695,2008.
[2] D. Hardisson, “Molecular pathogenesis of head and neck squamous cell carcinoma,” European Archives of Oto-RhinoLaryngology,vol.260,no.9,pp.502–508,2003.
[3] Gayen S, Maclary E, Buttigieg E, Hinten M, Kalantry S, “A Primary Role for the Tsix lncRNA in Maintaining Random X-Chromosome Inactivation,” Cell Rep,11(8):1251-1265,2015.
[4] Yoon JH, Abdelmohsen K, Gorospe M,“Posttranscriptional gene regulation by long noncoding RNA,” Journal of Molecular Biology,425(19):3723-3730,2013.
[5] Kawaguchi T, Tanigawa A, Naganuma T, Ohkawa Y, Souquere S, Pierron G, Hirose T,“SWI/SNF chromatin-remodeling complexes function in noncoding RNA-dependent assembly of nuclear bodies,” Proc Natl Acad Sci USA,112(14):4304-4309,2015.
[6] J.M.Bernstein,C.R.Bernstein,C.M.L.West,andJ.J.Homer, “Molecular and cellular processes underlying the hallmarks of head and neck cancer,” European Archives of Oto-RhinoLaryngology,vol.270,no.10,pp.2585–2593,2013.
[7] M. Buckingham and F. Relaix, “The role of Pax genes in the development of tissues and organs: Pax3 and Pax7 regulate muscle progenitor cell functions,” Annual Review of Cell and DevelopmentalBiology,vol.23,pp.645–673,2007.
[8] C. Cillo, A. Faiella, M. Cantile, and E. Boncinelli, “Homeobox genes and cancer,” Experimental Cell Research, vol. 248, no. 1, pp.1–9,1999.
[9] M. Carrio, G. Arderiu, C. Myers, and N. J. Boudreau, “HomeoboxD10inducesphenotypicreversionofbreasttumorcellsin a three-dimensional culture model,” Cancer Research, vol. 65, no.16,pp.7177–7185,2005.
[10] M. T. Lewis, “Homeobox genes in mammary gland development and neoplasia,” Breast Cancer Research, vol. 2, no. 3, pp. 158–169,2000.
[11] T.Taketani,T.Taki,N.Shibuya,A.Kikuchi,R.Hanada,andY. Hayashi, “Novel NUP98-HOXC11 fusion gene resulted from a chromosomalbreakwithinexon1ofHOXC11inacutemyeloid leukemiawitht(11;12)(p15;q13),”CancerResearch,vol.62,no.16, pp.4571–4574,2002.
[12] S.Z.Raza-Egilmez,S.N.Jani-Sait,M.Grossi,M.J.Higgins,T. B. Shows, and P. D. Aplan, “NUP98-HOXD13 gene fusion in therapy-relatedacutemyelogenousleukemia,”CancerResearch, vol.58,no.19,pp.4269–4273,1998.
[13] L. Plowright, K. J. Harrington, H. S. Pandha, and R. Morgan, “HOX transcription factors are potential therapeutic targets in non-small-cell lung cancer (targeting HOX genes in lung cancer),”BritishJournalofCancer,vol.100,no.3,pp.470–475, 2009.
[14] D.X.Nguyen,A.C.Chiang,X.H.-F.Zhangetal.,“WNT/TCF signalingthroughLEF1andHOXB9mediateslungadenocarcinomametastasis,”Cell,vol.138,no.1,pp.51–62,2009.
[15] M. Shimoda, M. Takahashi, T. Yoshimoto, T. Kono, I. Ikai, and H. Kubo, “A homeobox protein, Prox1, is involved in the differentiation, proliferation, and prognosis in hepatocellular carcinoma,”ClinicalCancerResearch,vol.12,no.20,pp.6005– 6011,2006.
[16] K.W.Tsai,Y.L.Liao,C.W.Wu,L.Y.Hu,andS.C.Li,“Aberrant expressionofmiR-196aingastriccancersandcorrelationwith recurrence,” Genes Chromosomes & Cancer, vol. 51, no. 4, pp. 394–401,2012.
[17] 罗华荣, 刘昭辉, 吴登龙等,膀胱尿路上皮癌与正常尿路上皮组织LncRNA表达谱差异性的研究,现代泌尿外科杂志,21(007):550-555,2016.
基金项目:黑龙江省卫生计生委科研课题编号(2018017)[非常重要]