1 延安大学医学院, 陕西延安 716000;
2延安大学附属医院 感染病科,陕西延安716000
【摘要】病毒感染如今对人群感染极大。本文作者以乙型肝炎为基础,结合国内外研究结果入手,就NLR家族在机体抗病毒方面的研究进展做一综述。
【关键词】NLR家族;抗病毒;乙肝
天然免疫系统一方面可以通过炎症反应等机制直接清除感染,另一方面还可诱导获得性免疫系统的活化,进而激发更加高效和特异性的免疫反应。真核生物天然免疫系统依靠为数较少的模式识别受体(pattern-recognition receptors,PRRs)来识别细菌、病毒等外来微生物。在高等动物中迄今已经发现了至少5大家族的模式识别受体,分别是Toll-样受体(Toll-like receptor,TLR),视黄酸诱导基因-样受体(RIG-I-like receptor,RLR);NOD-样受体(nucleotide-binding domain-like receptor,NLR);C型凝集素受体(C-type lectin receptors,CLRs);PYHIN蛋白家族又称干扰素诱导蛋白-200家族(the interferon(IFN)inducible p200, HIN-200)。
天然免疫系统能够通过识别保守的病原体结构(pathogen-assoeiated molecular-patterns,PAMPs)来识别病原微[1]生物。机体天然免疫细胞通过其包膜表面或者胞质中表达的受体来识别保守的病原体结构。这些受体包括Toll样受体,Nod样受体和AIM2(absent in melanoma 2:黑素瘤缺乏因子2)等。TLRs一般在细胞膜表面或内体识别保守的病原体结构分子,AIM2、NLRs和RLR等受体识别细胞质中的微生物分子[1, 2],这些受体活化后能够激活宿主的信号转导反应,继而启动机体天然免疫和获得性免疫。研究表明TLR、AIM2、IFI16、和NLRs及其炎症复合体的形成和机体抗病毒免疫密切相关。
1.炎症复合体(inflammasome)
2002年Fabio Martinon等提出炎症复合体的概念[3]。炎症复合体主要由NLR(NLRP1,NLRP3,NLRC4(IPAF),NLRP6 and NLRP12)或者PYHIN家族(包括AIM2、IFI16)构成,本质上是由多个蛋白组成的分子复合物,能够介导胱天蛋白酶-1(caspase-1)的活化。炎症复合体成分包括NLRs、AIM2等天然免疫受体以及接头蛋白(ASC)和caspase-1等分子。caspase-1活化后能够促进炎性细胞因子包括白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-18(interleukin-18,IL-18),和白细胞介素-33(interleukin-33,IL -33)等的成熟和释放。
某些胞浆蛋白和核蛋白缺乏靶向运输至内质网的信号肽,他们可通过不依赖于内质网至高尔基复合体途径释放到细胞外[4]。例如,IL-1β和IL-18等的成熟和释放就不依赖于内质网和高尔基复合体途径,这些类似于IL-1β和IL-18的非经典分泌途径的蛋白质多达20多种[5]。IL-1β和IL-18先以前体形式产生存在于胞质中, 研究证实[7],前体IL-1β和前体IL-18的成熟和分泌需要相应炎症复合体的形成并活化caspase-1来完成,即:前体IL-1β和IL-18需要活化的caspase-1介导的剪接才能够成熟和释放。乙肝病毒(HBV)感染机体是否存在此信号通路有待证实。
成熟的IL-1β 和 IL-18在宿主发起和进行特异性免疫过程中发挥着重要的作用,而IL-1β 和 IL-18的成熟和释放与天然免疫关系密切。
2.NLRs家族
小鼠NLRs家族包括34个成员,人类包含23个成员[6]。大多数的NLRs有一个多变的氨基端结构域,此结构域常包括数个与蛋白质之间相互作用的模块,这些模块通过与效应蛋白或接头蛋白相互作用来活化下游的信号转导分子;梭基端是富含亮氨酸的重复结构域,能够选择性识别病原体分子或其结构成分;中间的部分是能够介导自身多聚化的核酸结合寡聚化结构域。最先被鉴定的NLRs 是Nodl和Nod2。病原菌或者其他微生物特定成分将Nodl和Nod2激活后,NF-κB和MAPK(mitogen- activated protein kinase)信号通路便被活化的Nodl和Nod2诱导激活,这可以促进参与天然免疫和获得性免疫有关的基因的转录和表达[7]。NLRP1和NLRP3(也称为cryopyrin或者NALP3)、NLRC4(也称为IPAF)等一些NLRs、在生理和一些病理情况下可以形成炎性复合体,能够介导caspase-1活化
[8],参与机体的天然免疫和激活后续的特异性免疫。一系列的研究证据显示:NLRP3炎症复合体可能直接通过提呈RNA 和DNA病毒 [9]发挥抗病毒免疫作用。最近的研究表明NOD2间接参与机体I型干扰素的合成[10,11] ,NLRC5 [12]参与调节干扰素的转录,在机体抗病毒免疫反应中发挥重要作用。NLRX1是否是机体抗病毒免疫的负性调节因子尚有争议[13]。
4. 结论与展望
机体抗病毒及抗其他病原体的天然免疫反应的关键之一是快速激活并形成炎症复合体[14]。研究表明,机体在天然免疫过程中普遍存在如下信号转导途径[7](图1):
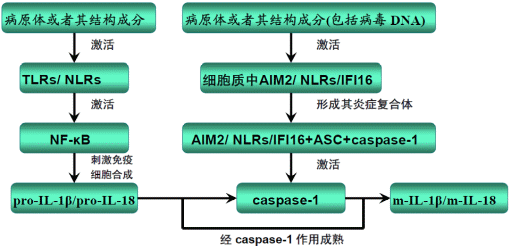 ①病原微生物或者其结构成分入侵机体→激活TLRs/ Nod1/ Nod2 →激活NF-κB →刺激机体合成pro-IL-1β/ pro-IL-18;②病原微生物或者其结构成分(包括病毒DNA)入侵机体细胞→激活胞质内AIM2/ IFI16/NLRs并形成其炎性复合体→激活caspase-1;③pro-IL-1β/pro-IL-18→经活化的caspase-1作用→形成mlL-1β/mIL-18并分泌至细胞外发挥其生物学效应。而且这也与获得性免疫的充分激活密切相关。
①病原微生物或者其结构成分入侵机体→激活TLRs/ Nod1/ Nod2 →激活NF-κB →刺激机体合成pro-IL-1β/ pro-IL-18;②病原微生物或者其结构成分(包括病毒DNA)入侵机体细胞→激活胞质内AIM2/ IFI16/NLRs并形成其炎性复合体→激活caspase-1;③pro-IL-1β/pro-IL-18→经活化的caspase-1作用→形成mlL-1β/mIL-18并分泌至细胞外发挥其生物学效应。而且这也与获得性免疫的充分激活密切相关。
pro-IL-1β/ pro-IL-18:前体lL-1β/lL-18; mlL-1β/mIL-18:成熟的lL-1β/lL-18
图1 AIM2/ NLRs/IFI16炎症复合体活化及相应信号转导模式图
越来越多的研究表明NLRs在机体抗病毒免疫防御中起重要作用。据报道[15],HBV刺激人的外周血单个核细胞,能够产生IL-18,这提示炎症复合体可能参与了乙型肝炎的机体免疫。有趣的是,另外一些研究结果表明NLRs不能识别某些病毒,也可能一些病毒已经进化出能够抑制他们信号传导途径的能力或阻断NLRs识别病毒基因组DNA的能力[16]。NLRs是否识别HBV或HBVDNA,是否参与了乙型肝炎机体免疫清除HBV的免疫反应,尚有待于研究证实。
References
[1] Franchi L, McDonald C, Kanneganti TD, Amer A, Nunez G. Nucleotide-binding oligomerization domain-like receptors: intracellular pattern recognition molecules for pathogen detection and host defense. J Immunol. 2006. 177(6): 3507-13.
[2] Ye Z, Ting JP. NLR, the nucleotide-binding domain leucine-rich repeat containing gene family. Curr Opin Immunol. 2008. 20(1): 3-9.
[3] Martinon F, Burns K, Tschopp J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Mol Cell. 2002. 10(2): 417-26.
[4] Nickel W, Rabouille C. Mechanisms of regulated unconventional protein secretion. Nat Rev Mol Cell Biol. 2009. 10(2): 148-55.
[5] Mariathasan S, Newton K, Monack DM, et al. Differential activation of the inflammasome by caspase-1 adaptors ASC and Ipaf. Nature. 2004. 430(6996): 213-8.
[6] Ting JP, Lovering RC, Alnemri ES, et al. The NLR gene family: a standard nomenclature. Immunity. 2008. 28(3): 285-7.
[7] Kim YG, Park JH, Shaw MH, Franchi L, Inohara N, Nunez G. The cytosolic sensors Nod1 and Nod2 are critical for bacterial recognition and host defense after exposure to Toll-like receptor ligands. Immunity. 2008. 28(2): 246-57.
[8] Martinon F, Tschopp J. Inflammatory caspases and inflammasomes: master switches of inflammation. Cell Death Differ. 2007. 14(1): 10-22.
[9] Kanneganti TD, Body-Malapel M, Amer A, et al. Critical role for Cryopyrin/Nalp3 in activation of caspase-1 in response to viral infection and double-stranded RNA. J Biol Chem. 2006. 281(48): 36560-8.
[10] Sabbah A, Chang TH, Harnack R, et al. Activation of innate immune antiviral responses by Nod2. Nat Immunol. 2009. 10(10): 1073-80.
[11] Shaw MH, Kamada N, Warner N, Kim YG, Nunez G. The ever-expanding function of NOD2: autophagy, viral recognition, and T cell activation. Trends Immunol. 2011. 32(2): 73-9.
[12] Benko S, Magalhaes JG, Philpott DJ, Girardin SE. NLRC5 limits the activation of inflammatory pathways. J Immunol. 2010. 185(3): 1681-91.
[13] Moore CB, Bergstralh DT, Duncan JA, et al. NLRX1 is a regulator of mitochondrial antiviral immunity. Nature. 2008. 451(7178): 573-7.
[14] Petrilli V, Dostert C, Muruve DA, Tschopp J. The inflammasome: a danger sensing complex triggering innate immunity. Curr Opin Immunol. 2007. 19(6): 615-22.
[15] Manigold T, Bocker U, Chen J, et al. Hepatitis B core antigen is a potent inductor of interleukin-18 in peripheral blood mononuclear cells of healthy controls and patients with hepatitis B infection. J Med Virol. 2003. 71(1): 31-40.
[16] Rathinam VA, Jiang Z, Waggoner SN, et al. The AIM2 inflammasome is essential for host defense against cytosolic bacteria and DNA viruses. Nat Immunol. 2010. 11(5): 395-402.